下列离子方程式书写不正确的是 ( )
A.铝与盐酸反应:2Al+6H+===2Al3++3H2  |
| B.氢氧化铝与NaOH溶液反应:Al(OH)3+OH-===AlO2-+2H2O |
| C.铁与FeCl3溶液反应:Fe+Fe3+===2Fe2+ |
| D.氧化铝与NaOH溶液反应:Al2O3+2OH-==2AlO2-+H2O |
把0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,溶液显酸性,下列叙述正确的是
| A.c(CH3COO-)>c(Na+) |
| B.c(CH3COOH)> c(CH3COO-) |
| C.c(CH3COOH)+ c(CH3COO-)=0.1mol•L-1 |
| D.加入少量NaOH固体,c(Na+)增大而c(CH3COO-)减小 |
在一定条件下,固定容积的密闭容器中反应:2NO2(g) 2NO (g) +O2 (g)△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
2NO (g) +O2 (g)△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是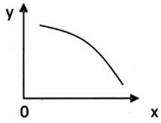
| A.当X表示温度时,Y表示NO2的物质的量 |
| B.当X表示压强时,Y表示NO2的转化率 |
| C.当X表示反应时间时,Y表示混合气体的密度 |
| D.当X表示NO2的物质的量时,Y表示O2的物质的量 |
下列有关实验原理或实验操作正确的是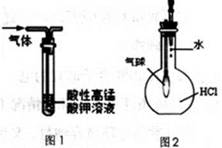
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用图1装置能除去乙烷中混有的乙烯,得到纯净的乙烷 |
| C.用图2装置能验证HC1气体在水中的溶解性 |
| D.用25mL碱式滴定管量取20.00 mL KMnO4溶液 |
下列关于有机物的叙述正确的是
| A.向乙酸乙酯中加人饱和Na2CO3溶液,振荡、分液除去乙酸乙酯中的少量乙酸 |
| B.淀粉和纤维素互为同分异构体 |
| C.油脂在体内水解为氨基酸和甘油,氧化放出热量,提供生命活动的能量 |
| D.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 |
下列叙述正确的是
| A.标准状况下,2.24LNH3中含有6.02×1022个N—H共价键 |
| B.100 mL 1 mol/L 的Na2CO3溶液中含有6.02×1022个CO32- |
| C.将4gNaOH溶于100g蒸溜水,所得溶液物质的量浓度是1.0mol/L |
| D.将7.8gNa2O2放入足量的水中,反应时转移6.02×1022个电子 |