2010年7月3日,福建省紫金矿业集团有限公司铜矿湿法厂发生污水渗漏事故,导致汀江部分河段污染,铜离子是污水的主要成分。下列说法正确的是( )
| A.该污水呈酸性 |
| B.该污水呈碱性 |
| C.污水中铜离子有杀菌作用,对水质没有影响 |
| D.向被污染水质中加入大量的氢氧化钡,可以治理被污染的水质 |
实验操作的规范是实验的基本要求。下列实验操作正确的是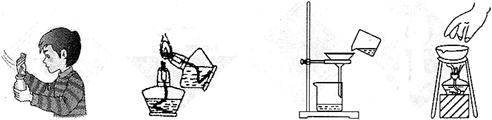
A B C D
下列溶液中Cl-浓度最小的是
| A.200mL 2mol/L MgCl2溶液 | B.300mL 2.5mol/L FeCl3溶液 |
| C.300mL 2.5mol/L NaCl溶液 | D.250mL 1mol/L AlCl3溶液 |
下列各组混合物中,能用分液漏斗进行分离的是
| A.水和CCl4 | B.碘和酒精 | C.酒精和水 | D.汽油和植物油 |
下列属于电解质并能导电的物质是
| A.淀粉 | B.KNO3溶液 | C.FeCl3晶体 | D.熔融的NaCl |
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注。 U是一种重要的核燃料,这里的“235”是指该原子的
U是一种重要的核燃料,这里的“235”是指该原子的
| A.质子数 | B.中子数 | C.电子数 | D.质量数 |