下列关于浓硫酸的叙述中,正确的是
| A.浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
| C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等 |
| D.浓硫酸在常温下能够使铁、铝等金属形成致密的氧化膜而钝化 |
化学与生产生活、环境保护密切相关。下列说法中不正确的是
| A.加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| B.人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
| C.方便面的制作过程中常用到纯碱,葡萄酒中一般加入少量SO2作为添加剂 |
| D.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
下列说法正确的是
| A.pH=5的NH4 Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.常温时将pH=3的醋酸和pH=ll的NaOH溶液等体积混合后,pH >7 |
| C.在c(H+):c(OH-)=1:l012的溶液中,N a+、I-、NO3-、SO42-能大量共存 |
| D.0.1 mol/L Na2 CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中 |
c(Na+)+c( H+) =c(CO32-)+c( SO42-)+C( HCO3-)+c(OH-)
下列说法正确的是
A.检验某酸性溶液中C1-和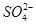 ,选用试剂及顺序是过量Ba(NO3)2溶液、AgNO3溶液 ,选用试剂及顺序是过量Ba(NO3)2溶液、AgNO3溶液 |
| B.将CO2和SO2混合气体分别通人BaC12溶液、Ba(NO3)2溶液中,最终都有沉淀生成 |
| C.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 |
| D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚。其结构简式如下图。有关瘦肉精的说法不正确的是
| A.化学式为C12H18ONH2C12 |
| B.遇FeCl3溶液发生显色反应 |
| C.属于芳香族化合物 |
| D.可以发生取代、加成、水解、酯化、消去反应 |