已知合成氨的反应为:N2(g)+3H2(g)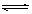 2NH3(g);△H=-QkJ·mo(Q>0)。
2NH3(g);△H=-QkJ·mo(Q>0)。
在同温同压下向密闭容器甲中通入lmolN2和3molH2,达平衡时,放出的热量为QlkJ;
向另一容积相同的密闭容器乙中通入0.5molN2和1.5 molH2,反应达平衡时,放出的热量为Q2kJ。则下列关系式正确的是
| A.2Q2<Ql<Q | B.2Q2=Q1<Q | C.2Q2=Q1=Q | D.Ql<Q2<Q |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
茶叶中铁元素的检验可经过以下四个步骤完成各步骤中选用的实验用品不能都用到的是(Fe3+的检验滴加KSCN溶液)
| A.将茶叶灼烧灰化,选用①、②和⑨ |
| B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C.过滤得到的滤液,选用④、⑤和⑦ |
| D.检验滤液中的Fe3+,选用⑨、⑧和⑩ |
某无色溶液中加入铝片可以生成氢气,则该溶液中一定能大量共存的离子组是
对下列实验过程的评价,正确的是
| A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
| B.用Ba(NO3)2溶液鉴别Cl-、SO42-、C032- |
| C.检验某溶液中是否含有SO42-时,应取少量的该溶液,依次加入BaCl2和稀盐酸 |
| D.验证某溶液中是否含Cl-,先加入过量的稀硝酸,再加入AgNO3溶液,有白色沉淀,则证明含Cl- |
等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液中SO42-的物质的量浓度比为
A.1:2:3B.1:6:9c.1:3:3D.1:3:6