每年由于腐蚀造成的钢铁损失约占年产量的10~20%,金属的防腐十分重要。钢铁防腐方法有许多种,图—1与图—2是两个典型的例子。对其中原理的描述正确的是 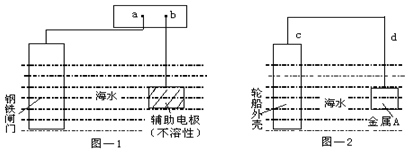
| A.图—1:a为电源正极 | B.图—1:辅助电极上的反应:O2+4e+2H2O→4OH- |
| C.图—2:电子流动方向d→c | D.图—2:金属A可以是耐腐蚀的金属铜 |
下列各组混合物中,可以用分液漏斗分离的是()
| A.溴苯和水 | B.乙酸和乙醇 | C.酒精和水 | D.溴苯和苯 |
下列物质属于有机物的是()
A.氰化钾(KCN)B.氯化钠(NaCl) C.尿素(NH2CONH2)D.碳化硅(SiC)
第一位人工合成有机物的化学家()
| A.门捷列夫 | B.维勒 | C.拉瓦锡 | D.牛顿 |
某有机物A的结构简式如图,下列有关A的说法正确的是 ( )
| A.分子式为:C14H15O6NBr |
| B.该分子中含有两个手性碳原子 |
| C.不能使酸性高锰酸钾溶液褪色 |
| D.A在一定条件下与氢氧化钠溶液反应,1 mol A最多消耗4 mol NaOH |
下列各组中的反应,属于同一反应类型的是()
| A.乙烯水化制乙醇;溴乙烷水解制乙醇 |
| B.甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色 |
| C.乙醇脱水制乙烯;溴乙烷与NaOH乙醇溶液共热制乙烯 |
| D.苯的硝化;苯与氢气(镍作催化剂)制取环己烷 |