设NA为阿伏加德罗常数,下列说法正确的是 ( )
| A.1.8g 重水(D2O)含有的电子数为1NA |
| B.2.3g金属钠反应生成Na2O2时失去的电子数为0.1NA |
| C.标准状况下,11.2 L的H2O所含的分子数为0.5NA |
| D.常温常压下,22.4LCl2与足量的铝充分反应,转移电子数为2NA |
对于体积相同的①(NH4) 2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是()
| A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>① |
| B.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是① |
C.溶液的pH相同时,由水电离出的 大小顺序是③>②>① 大小顺序是③>②>① |
| D.若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③ |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用上图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。下列正确的是:()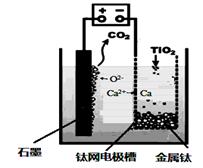
| A.由TiO2制得1mol 金属Ti ,理论上外电路转移2NA电子 |
| B.阳极的电极反应式为:C + 2O2- - 4e- ="=" CO2↑ |
| C.若用铅蓄电池作该装置的供电电源,“ +”接线柱应连接Pb电极 |
| D.在制备金属钛前后,整套装置中CaO的总量减少 |
某温度下 H2(g)+I2(g) 2HI(g)的平衡常数K="O.25" ,该温度下在甲、乙、丙三个恒容密闭容器中充入H2 (g)、 I2 (g),起始浓度如下表所示:
2HI(g)的平衡常数K="O.25" ,该温度下在甲、乙、丙三个恒容密闭容器中充入H2 (g)、 I2 (g),起始浓度如下表所示: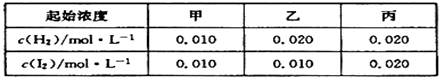
下列判断不正确的是()
| A.平衡时甲中和丙中H2的转化率相同 |
| B.平衡时乙中I2的转化率小于40% |
| C.平衡时乙中c(HI)比甲中的2倍大 |
| D.反应平衡时,丙中气体颜色最深,乙中气体颜色最浅 |
下列说法不正确的是()
| A.分子式为C9H10的含苯环的烯烃(不考虑立体异构)共有6种 |
B.芥子醇(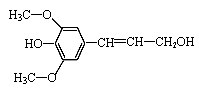 )能发生氧化、取代、水解、加聚反应 )能发生氧化、取代、水解、加聚反应 |
| C.实验室制乙烯时,把生成的气体通入酸性KMnO4溶液,紫色褪去,不能说明一定生成了乙烯 |
| D.将少量某物质的溶液滴加到新制银氨溶液中,水浴加热后有银镜生成,该物质不一定属于醛类 |
下列实验描述,不正确的是()
| A.同样是在氯气中点燃,铁少量生成的是氯化铁,过量时则生成氯化亚铁 |
| B.同样是试纸检测,检验气体需要润湿,检验溶液时则一般不能润湿 |
| C.同样是配制溶液,一定质量分数的溶液配制使用烧杯,而一定物质的量浓度的溶液配制则还需要容量瓶 |
| D.同样是浓溶液(设其质量分数为ω )与水等体积混合,所得硫酸的浓度大于 0.5ω ,氨水的则小于 0.5ω |