有机物的结构可用“键线式”简化表示。CH3-CH=CH-CH3可简写为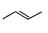 ,某有机物X的键线式为:
,某有机物X的键线式为: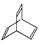
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式。
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式:
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z ,Z的二氯代物有 种。
依据事实,写出下列反应的热化学方程式.
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O. 放出571.6kJ的热量,表示H2燃烧的热化学方程式为__________
(2)在25℃、101kPa下,1g甲醇(CH3OH)液体燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为______ _
(3)已知:已知:C(s)+O2(g)=CO2(g)△H=﹣437.3kJ•mol一1
H2(g)+ O2(g)═H2O(g)△H=﹣285.8kJ•mol一1
O2(g)═H2O(g)△H=﹣285.8kJ•mol一1
CO(g)+ O2(g)═CO2(g)△H=﹣283.0kJ•mol一1
O2(g)═CO2(g)△H=﹣283.0kJ•mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是_____ ____
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
工业上用软锰矿(主要成分是二氧化锰)制取高锰酸钾和软磁铁氧体材料MnxO4,其流程如下(部分条件和产物省略):
请回答下列问题: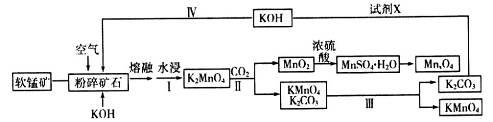
(1)K2MnO4中锰元素的化合价是___________。
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式___________________。
(3)分析下表数据。工业上采用III得到较纯净的高锰酸钾,III中包含的操作名称是________________。
(4)上述工业流程中试剂X的最佳物质是(填化学式)_________________________;设计步骤IV的目的是________________________。
(5)通过煅烧MnSO4·H2O可制得软磁铁氧体材料MnxO4。如图是煅烧MnSO4·H2O时温度与剩余固体质量变化的曲线。该曲线中A段所表示物质的化学式是_____________;MnxO4中x=_________________________。
许多含氯物质与生活密切相关,如HClO、ClO2、NaClO2等都是重要的杀菌消毒剂和漂白剂。其中制备NaClO2的工业流程下图所示: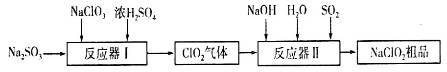
请回答下列问题:
(1)反应器I中反应的氧化剂是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为_________________________________。
(3)通入反应器Ⅱ中的SO2能用H2O2代替,请简要说明理由____________________。
(4)为了测定NaClO2粗品的纯度,取上述粗产品10.0 g溶于水配成1 L溶液,取出10 mL,溶液于锥形瓶中,再加入足量酸化的KI溶液。充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3标准液漓定,达到滴定达终点时用去标准液20.00 mL,试计算NaClO2粗品的纯度___________。(提示:2Na2S2O3+I2====Na2S4O6+2NaI)
常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去)。F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素。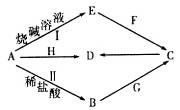
请回答下列问题:
(1)写出F的电子式________________,实验室制取G的化学方程式为______________________。
(2)写出反应I的离子方程式_______________。该反应中的氧化剂是______________________。
(3)反应I、Ⅱ均有清洁能源H2产生。已知H2的燃烧热为286 kJ·mol-1,18 g水蒸气变成液态水放出44 kJ的热量。其它相关数据如下表:
则表中x为______________
(4)写出A与H反应的化学方程式________________________________,实验测得该反应的焓变(△H)和活化能(Ea)。下列能量关系图合理的是_________________(填写序号)。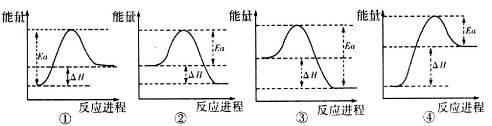
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性)。在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为_______________________________。