下列化学反应的离子方程式,书写不正确的是
| A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++ SO42-= BaSO4↓ |
B.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH—=AlO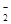 +2H2O +2H2O |
| C.氯化亚铁溶液中通入少量氯气:Cl2+ 2Fe2+=2Fe3+ +2Cl— |
| D.向碳酸钙固体中加入稀盐酸: CaCO3+2H+=Ca2+ +CO2↑+H2O |
在三个体积相同的密闭容器中分别充入Ne、H2、O2三种气体,当他们的温度和密度都相同时,这三种气体的压强(p)由大到小的顺序是()
| A.p(Ne)>p(H2) >p(O2) | B.p(O2) >p(Ne)>p(H2) |
| C.p(H2)>p(O2)>p(Ne ) | D.p(H2)>p(Ne)>p(O2) |
NA表示阿伏加德罗常数,下列叙述正确的是()
| A.22.4L的N2和CO所含分子数均为NA |
| B.1.7g H2O2中含有的电子数为0.9 NA |
| C.标准状况下,11.2L H2O含有的分子数为0.5NA |
| D.含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
.硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 m ol/L,硫酸根离子浓度为
ol/L,硫酸根离子浓度为
0.7 mol/L,则K+的物质的量浓度为()
| A.0.1 mol/L | B.0.15 mol/L | C.0.3 mol/L | D.0.2 mol/L |
100mL 0.3mol/L K2SO4溶液和100mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42─的物质的量浓度为(忽略溶液混合时的体积变化)()
| A.0.30 mol/L | B.0.25mol/L | C.0.50mol/L | D.0.45mol/L |
关于某无色溶液中所含离子的鉴别,下列判断正确的是()
| A.加入AgNO3溶液,生成白色沉淀,可确定Cl─存在 |
| B.加入稀盐酸无明显现象,再加BaCl2溶液生成白色沉淀,可确定SO42─存在 |
| C.加入BaCl2溶液,生成白色沉淀,可确定SO42-存在 |
| D.某固体加入盐酸,生成的气体能使澄清石灰水变浑浊,则该固体中一定含有CaCO3 |