(10南京市22).(12分)某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制200g质量分数为8%的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为 ▲ g,水的体积为 ▲ mL(水的密度近似看作1g/cm3)。
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的 ▲ 盘,称量其质量。然后 ▲ (按操作的先后顺序选填字母),直至天平平衡。
A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码
该步骤中用烧杯而不用纸称量氢氧化钠的原因是 ▲ .
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)如图表示用上述配制的氢氧化钠溶液与20 g某稀盐酸发生反应后溶液温度的变化情况。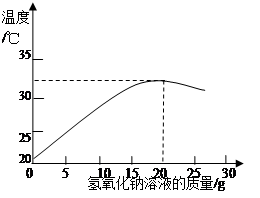
①根据曲线判断,当加入氢氧化钠溶液的质量为 ▲ 时,反应恰好完全进行。
②当加入15 g氢氧化钠溶液时,所得溶液中的溶质为 ▲ (写化学式)。
③试计算该稀盐酸中溶质的质量分数(请写出计算过程) ▲
今有氢氧化钠、碳酸氢钠和与其他物质都不反应,受热也不分解的杂质组成的固体混合物17.110g,放入密闭容器中加热至250℃,经充分反应后,将容器中的气体通入过量的澄清石灰水中得到白色沉淀2.500g;当容器中的残留固体冷却到室温后,全部溶于水制成50.00ml溶液,从中取出10.00ml,恰好可与含HCl 1.825g的盐酸溶液25.00毫升中和至中性,求原混合物中含杂质的质量分数?
在稀H2SO4和CuSO4的混合溶液中,加入适量铁粉,使其正好完全反应,反应后经过过滤得到固体物质的质量与所加铁粉的质量相等,则混合溶液中H2SO4与CuSO4的质量比为。
钛(Ti)是一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。在一定条件下,钛可以由四氯化钛(TiCl4)和金属镁反应而制得:TiCl4 + 2Mg  Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)
Ti + 2MgCl2。现有380kg四氯化钛,理论上可生产纯度为95%的金属钛多少千克?(计算结果保留一位小数)
某纯碱样品中含有少量氯化钠。为测定样品中碳酸钠的质量分数,现称取该样品11 g,加入到盛有50 g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6 g。计算:
(1)完全反应后生成CO2的质量;
(2)纯碱样品中碳酸钠的质量分数(结果精确到0.1%)。
我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 3CO+Fe2O3 2Fe+3CO2。
2Fe+3CO2。
(1)求Fe2O3中铁元素的质量分数。
(2)根据化学方程式计算:用含Fe2O360%的赤铁矿石800 t,理论上可炼出纯铁多少吨?