用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作导致结果偏低的是( )
| A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D.滴定前读数正确,达到滴定终点后,俯视读数 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是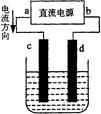
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
分析下面的能量变化示意图,下列热化学方程式正确的是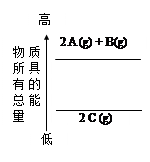
| A.2A(g)+ B(g)=2C(g);△H="a" kJ·mol-1(a>0) |
| B.2A(g)+ B(g)=2C(g);△H=akJ·mol-1(a<0) |
| C.2A + B="2" C;△H="a" kJ·mol-1(a<0) |
| D.2C="2A" +B;△H="a" kJ·mol-1(a>0) |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol·L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
反应4A(g )+3B(g) ==2C(g)+D(g),经2min,B的浓度减少0.6 mol•L-1。对此反应速率的表示,正确的是
①用A表示的反应速率是0.4 mol•L-1•min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①② B. ③ C. ① D. ②④
在一定温度下,向a L密闭容器中加入1 mol X气体和 2 mol Y 气体,发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是
| A.容器内压强不随时间变化 |
| B.V正(X)=V逆(Z) |
| C.容器内X、Y、Z的浓度之比为l∶2∶2 |
| D.单位时间消耗0.1 mol X同时生成0.2 mol Z |