下列四组实验中现象或结论不正确的是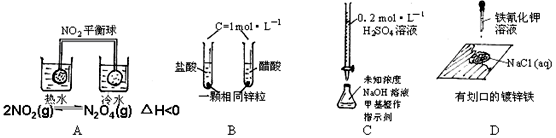
| 序号 |
实验现象 |
结 论 |
| A |
热水中平衡球颜色比冷水中深 |
升温,化学平衡向吸热反应方向移动 |
| B |
起始时产生气泡速率HCl > CH3COOH |
醋酸是弱电解质 |
| C |
溶液颜色由黄变橙,且30秒内不变色 |
已达滴定终点 |
| D |
划口处有蓝色沉淀 |
铁发生了析氢腐蚀 |
将NaOH溶液逐滴加入NH4HCO3溶液中(忽略溶液体积的变化),下列各示意图表示的混合溶液有关量的变化趋势正确的是()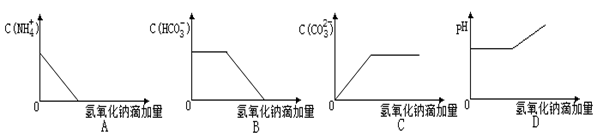
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是()
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13.44 L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在pH=5时已完全沉淀,其分析错误的是()
| A.用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 |
| B.利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果 |
| C.洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次 |
| D.若要实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳 |
铝是一种很重要的金属,可以发生一系列反应制备物质。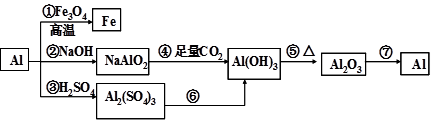
下列说法错误的是( )
| A.反应①又称铝热反应,曾用于野外焊接铁轨 |
| B.利用②③反应都能产生氢气,产生等量氢气消耗Al的质量也相等且转移电子数也相等 |
| C.常用反应⑥制备Al(OH)3,方法是向Al2(SO4)3溶液中滴加NaOH溶液至恰好完全沉淀 |
| D.工业上常用反应⑦制备金属铝,制备过程中常加入冰晶石以降低Al2O3的熔点 |
硅作为一种新型能源被广泛开发利用,关于其有利因素的下列说法中,你认为不正确的是( )
| A.硅燃烧产物对环境产生的污染,容易得到有效控制 |
| B.从Si(s)+O2(g)===SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量较多 |
| C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅 |
| D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一 |