配制一定物质的量浓度的H2SO4溶液时,造成所配溶液浓度偏高的原因可能是( )
| A.容量瓶中原来含有少量蒸馏水 |
| B.烧杯中稀释浓H2SO4后,未经冷却即转移至容量瓶并洗涤烧杯和玻璃棒后立即定容 |
| C.溶解浓H2SO4的烧杯没有洗涤 |
| D.向容量瓶中加水定容时眼睛一直仰视刻度线 |
将标准状况下的 LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
A.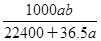 mo1·L-1 mo1·L-1 |
B.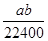 mol·L-1 mol·L-1 |
C.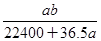 mol·L-1 mol·L-1 |
D.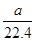 mol·L-1 mol·L-1 |
实现下列变化,一定要加入其它物质作氧化剂的是
| A.CaCO3 → CO2 | B.NaCl → NaNO3 |
| C.CuO → CuSO4 | D.Zn → ZnCl2 |
设阿伏加德常数为NA。则下列说法正确的是
| A.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
| B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA |
| C.常温常压下,18g H2O中含有的电子数为3NA |
| D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |
需要配制2mol/L的NaCl溶液950mL,应选用的容量瓶的规格和称取的NaCl质量分别是
| A.1000mL,117g | B.500mL,117g |
| C.950mL,111.2g | D.任意规格,111.2g |
下列反应中水作还原剂的是
| A.2Na + 2H2O = H2↑+ 2NaOH |
| B.Cl2+NaOH =" NaCl+" NaClO+H2O |
| C.SO2+Cl2+2H2O =" 2HCl+" H2SO4 |
| D.2F2 + 2H2O =" 4HF+" O2 |