浓度为2mol·L-1的氢溴酸溶液VL,欲使其浓度变为4 mol·L-1,以下列出的方法中,可行的为
| A.通入标况下的HBr气体44.8L |
| B.加入10 mol·L-1氢溴酸0.6VL,再将溶液稀释至2VL |
| C.蒸发掉0.5L水 |
| D.将溶液加热蒸发浓缩至0.5V |
下列说法正确的是
| A.电解、电镀、电化学腐蚀都需要通电才可进行 |
| B.Al、Fe、Cu三者对应的氧化物均为碱性氧化物 |
| C.浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 |
| D.从石油中得到汽油,可采用分馏的方法 |
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为
| A.22.1 g | B.27.2 g | C.30 g | D.无法计算 |
已知A、B为单质,C为化合物。
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加过量NaOH溶液,先出现浑浊后澄清,则B可能为Al
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
能实现上述转化关系的是
A.①② B.②④ C.①③ D.③④
为了探索外界条件对反应:aX(g)+bY(g) cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是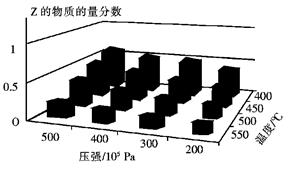
| A.△H<0,a+b>c |
| B.△H>0,a+b<c |
| C.△H>0,a+b>c |
| D.△H<0,a+b<c |
下列操作或实验现象预测正确的是
| A.实验I:振荡后静置,下层溶液颜色变深 |
| B.实验Ⅱ :烧杯中先出现白色沉淀,后溶解 |
| C.实验III:放置一段时间后,小试管内有晶体析出 |
| D.实验Ⅳ:为确认CuSO4生成,向①中加水,观察颜色 |