

 现有A、B、C、D、E、F六种化合物,已知它们的阳离子有
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有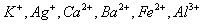 阴离子有
阴离子有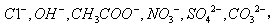 现将它们分别配成
现将它们分别配成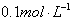 的溶液,进行如下实验:
的溶液,进行如下实验:
① 
 测得溶液A、C、E呈碱性,且碱性为A>E>C;
测得溶液A、C、E呈碱性,且碱性为A>E>C;
② 
 向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③ 
 向D溶液中滴加
向D溶液中滴加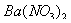 溶液,无明显现象;
溶液,无明显现象;
④ 
 向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
 根据上述实验现象,回答下列问题:
根据上述实验现象,回答下列问题:
(1)
 实验②中反应的化学方程式是
实验②中反应的化学方程式是 
 ;
;
 (2)E溶液是 ,判断依据是
(2)E溶液是 ,判断依据是 
 ;
;
 (3)写出下列四种化合物的化学式:A 、C 、
(3)写出下列四种化合物的化学式:A 、C 、
 D 、F .
D 、F .
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了下图所示的实验装置。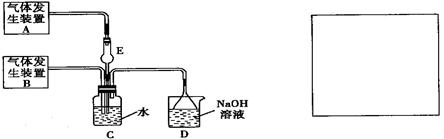
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是
;发生装置B应选择以下三种装置中的(填序号)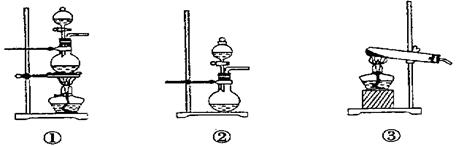
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式。
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g) SO2Cl2(l)△H=" -" 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
SO2Cl2(l)△H=" -" 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是(填序号)
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
②已知20℃时,AgCl的溶解度为1.5× 10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是。
10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是。
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示: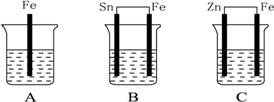
(1)A中反应的离子方程式是。
(2)B中Sn极的电极反应式为____________________,Sn极附近溶液的pH__________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是__________,总反应离子方程式是____________________,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是__________。
短周期元素A、B、C、D、E原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,B的单质为双原子分子,其氢化物能使湿 润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价。
润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价。
(1)写出E元素在周期表中的位置
(2)写出A元素气态氢化物的结构式
(3)B的氢化物和E的氢化物反应所得生成物的电子式为 。
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为 。
短周期元素X、Y、Z在周期中位置关系如图所示。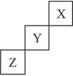
(1)X元素的单质分子式是_____________,若X核内中子数与质子数相等,X单质的摩尔质量是_____________。
(2)Z元素的单质是一种 _____________色的_____________体。该单质与铁粉反应的化学方程式为_____________________________________________________。
_____________色的_____________体。该单质与铁粉反应的化学方程式为_____________________________________________________。
(3)Y元素的单质与H2O反应的化学方程式为____________________________________,若1 mol Y单质反应,转移_____________mol电子。
回答下列问题
(1)画出磷原子的原子结构示意图:。
(2)写出H2S分子的电子式:。
(3)写出表示含有8个质子,10个中子的原子的化学符号: 。
。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a =。
(5)用电子式表示氯化镁的形成过程: 。
。
(6)写出Na2O2中所含化学键的类型。
(7)拆开1mol H—H键,1mol N—H键,1mol 键分别需要吸收的能量为436kJ ,391kJ,946kJ:
键分别需要吸收的能量为436kJ ,391kJ,946kJ:
则1mol N2完全转化成NH3热量(填“吸收”或“放出”)kJ;
(8)利用下列反应:Fe + Cu2+= Fe 2+ + Cu 制一个化学电池,写出电极反应式:
负极:;正极。