科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性。
(一)学生(甲)应用下图装置(A)所示意的方法研究氯气的性质,其中气体的主要成分是氯气(含有空气和水蒸气)。请回答下列问题: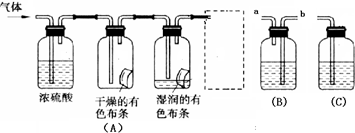
(1)该项研究(实验)的主要目的是
(2)浓硫酸的作用是 。与研究目的直接相关的实验现象是 ________________ _ 。
(3)虚框中的装置应选择 (填“B”或“C”),其盛放的试剂
为 (填试剂名称);使用该装置的目的是 ;该装置内发生反应的化学方程式为 。
(二)学生(乙)设计实验探究金属铝表面氧化膜的性质:将铝片(含氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。回答下列问题:
(1)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是 。
(2)同学(乙)认为:铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因是“氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能”。并设计如下实验方案进行验证,请你根据其思路完成下列空格:
[实验方案] 在硫酸铜溶液中加入铝片,无明显现象,再加入 (填试剂名称),若反应明显加快了,说明上述推断正确。
在Na+浓度为0.9mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
| 阳离子 |
K+、Ag+、Mg2+、Ba2+ |
| 阴离子 |
NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀HCl |
产生白色沉淀并放出1.12L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为3.6g |
| Ⅲ |
在Ⅱ的滤液中滴加BaC12溶液 |
无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
| 阴离子 |
NO3- |
CO32- |
SiO32- |
SO42- |
| c/mol·L-1 |
(4)判断K+是否存在 ,若存在求其最小浓度,若不存在说明理由 。
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
(1)将仪器连接好以后,必须进行的第一步操作是_____________。
(2)此实验还必须用到的最重要的仪器是_______;仪器F的作用是_______。
(3)已知仪器C中装有品红溶液,其作用是________ ___。
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.酸性高锰酸钾溶液
c.品红溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.碱石灰
g.无水硫酸铜
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是_____。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为_________。
(共12分)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”) 。
(6)写出NaOH溶液和盐酸反应表示中和热的热化学方程式 。
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇分子官能团名称是_______________。
(2)试管A中加入几块碎瓷片的目的是___________。
(3)试管A中发生反应的化学方程式为 ___________,反应类型是_______。
(4)反应开始前,试管B中盛放的溶液是____________。作用是___________。
(5)可用_________的方法把制得的乙酸乙酯分离出来。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。
(1)写出甲装置中电解饱和食盐水的离子方程式 。
(2)为完成上述实验,正确的连接顺序为A连________;B连________(填写导管口字母)。
(3)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作为________________。
(4)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是______________,对应的现象为_______。
乙装置烧杯中发生反应的离子方程式是 。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:________方案所测结果更准确。
你认为不合理的方案的不足之处是_____________________。
②若按合理方案测定的数据计算,Cu的相对原子质量为 。