在一定条件下发生下列反应,其中属于盐类水解反应的是
A.NH4++2H2O 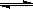 NH3·H2O+H3O+ NH3·H2O+H3O+ |
B.HCO3-+ H2O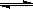 H3O+ + CO32- H3O+ + CO32- |
| C.HS-+H+="==" H2S |
D.Cl2+H2O 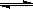 H++Cl-+HClO H++Cl-+HClO |
下列各组物质,若不用其他试剂,则无法鉴别的是()
| A.MgCl2、Na2CO3 | B.AlCl3、NaOH |
| C.NaAlO2、HCl | D.稀H2SO4、Na2CO3 |
我国最新报道的高温超导体中,铊(Tl)是组成成分之一。已知铊与铝是同族元素,关于铊的判断有错误的是()
| A.铊是银白色质软金属 |
| B.氢氧化铊是两性氢氧化物 |
| C.铊能生成+3价的化合物 |
| D.铊能置换出盐酸中的氢 |
若甲为100 mL、2 mol·L-1的AlCl3溶液,乙为100 mL、7mol·L-1的NaOH溶液,分别按以下两种步骤:将甲逐滴加入乙中;将乙逐滴加入甲中(边滴边振荡)完全混合后,对现象和结论的判断正确的是()
| A.滴加过程中,两者的现象不同,最终产生的沉淀量相同 |
| B.滴加过程中,两者的现象不同,最终产生的沉淀量不同 |
| C.滴加过程中,两者的现象相同,最终产生的沉淀量相同 |
| D.滴加过程中,两者的现象相同,最终产生的沉淀量不同 |
在含有大量 的溶液中,能同时大量存在的离子有()
的溶液中,能同时大量存在的离子有()
| A.Na+ | B.Al3+ | C.H+ | D.OH- |
下列物质:①NaHCO3②Al(OH)3③K2SO4④AgNO3中既能与HCl反应,又能与NaOH反应的是()
| A.②④ | B.①④ | C.③④ | D.①②④ |