下列有关反应热的说法中正确的是
| A.一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系 |
| B.中和热△H=-57.3kJ•mol-1,所以,1.00L 1.00mol•L-1H2SO4与稀的NaOH溶液恰 好完全反应放出57.3kJ的热量 |
| C.用等体积的0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液进行中和热测定的实验与 用等体积的0.50mol•L-1盐酸、0.50mol•L-1NaOH溶液进行中和热测定的实验相比,前者会使测得的中和热的数值偏大 |
| D.在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量是CH4的燃烧热 |
下列实验不能达到预期目的的是:
| 序号 |
实验操作 |
实验目的 |
| A |
配制FeCl2溶液时,向溶液中加入少量Fe和稀盐酸 |
抑制Fe2+水解和防止Fe2+被氧化 |
| B |
将饱和FeCl3溶液滴入沸水中,溶液变红褐色 |
制备Fe(OH)3胶体 |
| C |
测定等浓度的Na2CO3和Na2SO3 溶液的pH,前者pH比后者的大 |
比较S、C的非金属性强弱 |
| D |
将充满NO2的密闭玻璃球浸泡在热水中 |
研究温度对化学平衡移动的影响 |
在下列溶液中,各组离子一定能够大量共存的是
| A.在含有NaHCO3的溶液中:K+、SO42-、Cl-、Al3+ |
| B.使甲基橙变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C.c(H+) = 10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
| D.水电离的c(H+) = 10-11 mol·L-1的溶液:NH4+、K+、ClO-、Cl- |
下面是一段关于酸碱中和实验操作的叙述:
①取一锥形瓶,用待测NaOH溶液润洗两次。②在一锥形瓶中加入25 mL待测NaOH溶液。③加入几滴石蕊试剂做指示剂。④取一支酸式滴定管,洗涤干净。⑤直接往酸式滴定管中注入标准酸溶液,进行滴定。⑥左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶。⑦两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点。文中所述操作有错误的序号为
| A.④⑥⑦ | B.①⑤⑥⑦ | C.③⑤⑦ | D.①③⑤⑦ |
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各示意图混合溶液有关量或性质的变化趋势,其中错误的是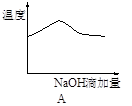
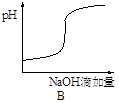
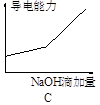
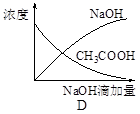
对于1L 0.1 mol·L-1 NH4Cl溶液,正确的是
| A.溶液呈碱性 |
| B.通入少量HCl,c(NH4+)和c(Cl-)均增大 |
| C.溶液中含有NH4+数目为0.1NA(NA表示阿伏加德罗常数的数值) |
| D.升高温度,溶液pH升高 |