下列叙述正确的是
| A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中, 溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.向AgCl悬浊液中滴入KI溶液,有AgI沉淀生成,说明AgCl的溶解度小于AgI 的溶解度 |
| C.0.2 mol?L-1盐酸与等体积0.05 mol?L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.0.2 mol?L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) |
化学反应N2+3H2 2NH3的能量变化如图所示,该反应的热化学方程式是
2NH3的能量变化如图所示,该反应的热化学方程式是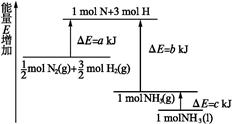
| A.N2(g)+H2(g)= NH3(l)ΔH=+(b+c-a) kJ·mol-1 |
| B.N2(g)+3H2(g)= 2NH3(g)ΔH=+2(b-a) kJ·mol-1 |
| C.N2(g)+3H2(g)= 2NH3(l)ΔH=-2(b+c-a) kJ·mol-1 |
| D.N2(g)+H2(g) = NH3(g) ΔH=+(a+b) kJ·mol-1 |
可逆反应2SO2(g)+O2(g) 2SO3(g),在不同条件下测得化学反应速率最快的为
2SO3(g),在不同条件下测得化学反应速率最快的为
| A.v(O2)=3 mol·L-1·min-1 |
| B.v (SO2) =4 mol·L-1·min-1 |
| C.v (SO3) =0.1 mol·L-1·s-1 |
| D.v (O2) =0.1 mol·L-1·s-1 |
一定量的稀硫酸与过量的锌反应,为减慢反应速率,且不影响生成氢气的总量,可向稀硫酸中加入适量的下列物质,其中一定不能达到目的的是
| A.硫酸铜固体 | B.水 | C.醋酸钾溶液 | D.氯化钠溶液 |
对于反应方向的判断,下列不正确的是
| A.ΔH<0,ΔS>0,所有温度下反应自发进行 |
| B.ΔH>0,ΔS>0,所有温度下反应自发进行 |
| C.ΔH<0,ΔS<0,低温下反应自发进行 |
| D.ΔH>0,ΔS<0,所有温度下反应不能自发进行 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是
①生成42.0 L N2(标准状况)
②有0.250 mol KNO3被氧化
③转移电子的物质的量为1.25 mol
④被氧化的N原子的物质的量为3.75 mol
| A.①② | B.③④ | C.②③ | D.①④ |