下列除去杂质的方法正确的是
| A.除去N2中的O2:通过灼热的CuO粉末,收集气体 |
| B.除去Cl2中的少量HCl:通过饱和NaCl溶液,收集气体 |
| C.除去FeCl2溶液中的少量FeC3:加入足量铁屑,充分反应后过滤 |
| D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液过滤 |
20mL0.1mol/LFeCl3溶液中含有部分Fe2+,向其中滴加NaOH溶液至PH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16。
下列说法错误的是
| A.沉淀中只有Fe(OH)3 | B.沉淀中有Fe(OH)3和Fe(OH)2 |
| C.滤液c(Fe3+)=4.0×10-8mol/L | D.向滤液中滴加FeCl2溶液,无沉淀产生 |
已知反应2H2(g)+CO(g)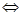 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
| 平衡常数 |
温度/℃ |
||
| 500 |
700 |
800 |
|
| K |
2.50 |
0.34 |
0.15 |
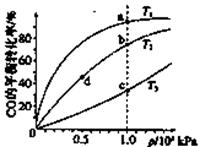
A. 平横常数:K(a)>K(c),K(b)=K(d)
B. 正反应速率:v(a)>v(c),v(b)=v(d)
C. 达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D. 平均相对分子质量:M(a)=M(c),M(b)>M(d)
常温下,将20mL0.1mol/L的HCl溶液逐滴加入到20mL0.1mol/LNa2C2O4溶液中。已知NaHC2O4溶液显酸性,关于反应混合溶液的下列判断不正确的是
| A.c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(HC2O4) |
B.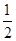 c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) |
| C.c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
| D.加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 |
下列化学实验叙述正确的是
| A.实验室从海带中提取单质碘的步骤:取样→灼烧→溶解→过滤→萃取 |
| B.将饱和FeCl3溶液滴入沸水,继续加热煮沸至出现红褐色沉淀即得Fe(OH)3胶体 |
| C.要检验滴有稀硫酸的蔗糖溶液是否水解,可加入银氨溶液,再水浴加热 |
| D.钠的焰色反应实验需要用酒精灯、铂丝、氯化钠溶液和稀盐酸 |
前四周期元素X、Y、Z、W、Q的原子序数依次增大。X与Y同周期相邻,Y的基态原子s电子数与p电子数相等,Z是地壳中含量最多的金属元素,W的价电子排布为4S1,基态Q原子的未成对电子是同周期元素中最多的。下列说法错误的是
| A.简单气态氢化物的热稳定性:Y>X |
| B.简单离子的半径:Z>X>Y |
| C.Z的最高价氧化物对应水化物既能与强酸反应又能与强碱反应生产盐和水 |
| D.由Y、W、Q三种元素形成的某种化合物,可用于检查司机酒后驾车 |