哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖, 。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
(1)此反应在50~60s时化学平衡常数为 = (列出计算式不用试算)。
= (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
在该条件下,氮气的化学反应速率 (填“变小”、“变大”或“不变”)
(3)该反应在80S后化学平衡常数为 ,则
,则
 (填“>”,“<”或“=”),此时氮气的转化率为 。
(填“>”,“<”或“=”),此时氮气的转化率为 。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数 。(填“变小”、“变大”或“不变”)
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α萜品醇G的路线之一如下:
已知:RCOOC2H5

请回答下列问题:
(1)A所含官能团的名称是________。
(2)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:________________。
(3)B的分子式为________;写出同时满足下列条件的B的链状同分异构体的结构简式:________________。
①核磁共振氢谱有2个吸收峰
②能发生银镜反应
(4)B→C、E→F的反应类型分别为________、________。
(5)C→D的化学方程式为______________________________________。
(6)试剂Y的结构简式为________________。
(7)通过常温下的反应,区别E、F和G的试剂是________和________。
(8)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________。
聚甲基丙烯酸羟乙酯的结构简式为 ,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式。
,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式。
(1)由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯:________________。
(2)由甲基丙烯酸制备甲基丙烯酸羟乙酯:________。
聚3羟基丁酸酯(PHB),被用于制造可降解塑料等。
PHB是由3羟基丁酸[CH3CH(OH)CH2COOH]分子聚合而成。合成聚-3-羟基丁酸酯的途径很多,其中有一种途径的副产物少、污染小、原子利用率高,其合成路线如下:
A+CH2=CH—CH=CH2 PHB
PHB
试回答下列问题:
(1)写出C中含有的官能团的名称是_________________________________。
(2)上述转化过程中属于加成反应的是________________(填序号)。
(3)反应②符合绿色化学思想(碳原子的有效利用率为100%),则A的结构简式为__________。
(4)写出反应④的化学方程式________________________________。
(5)写出与C互为同分异构体,能发生银镜反应,且核磁共振氢谱有两个吸收峰的有机物的结构简式为__________________________________________。
食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯(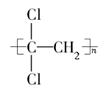 )具有超强阻隔性能,可作为保鲜食品的包装材料,它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料,它是由________(写结构简式)发生加聚反应生成的。
(2)劣质植物油中的亚油酸
[CH3(CH2)4CH—CHCH2CH—CH(CH2)7COOH]含量很低,下列关于亚油酸的说法中正确的是________。
| A.分子式为C18H34O2 |
| B.一定条件下能与甘油(丙三醇)发生酯化反应 |
| C.能和NaOH溶液反应 |
| D.能使酸性KMnO4溶液褪色 |
(3)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:
________________________________________
(4)劣质奶粉中蛋白质含量很低,蛋白质水解的最终产物是___________________。
(5)在淀粉中加入吊白块制得的粉丝有毒。淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作方法、现象和结论:
__________________________________________________。
有资料显示,几种甜味剂的相对甜度如下:
| 甜味剂名称 |
相对甜度 |
| 蔗糖 |
1 |
| 糖精 |
500~700 |
| 阿斯巴甜 |
180~200 |
| 纽甜 |
7000~13000 |
由上表可知目前发现的最甜的甜味剂是纽甜(NTM),它的结构简式如下:
试根据纽甜的结构简式回答下列问题:
(1)纽甜的分子式为________________________________。
(2)在纽甜分子中,除含有—CO—NH—、—COO—、苯基外,还含有亚氨基(—NH—)和________,因此该物质既具有________性,又具有________性。
(3)如果将纽甜在一定条件下完全水解(假设生成的产物中没有盐),则含有苯环的有机物的结构简式为________;如果保持该物质的碳链结构和羧基不变,则含有氨基的有机物的同分异构体(含自身1种)共有________种;该类物质可发生________(填反应类型)反应生成高分子化合物。
(4)纽甜可通过如下反应制得: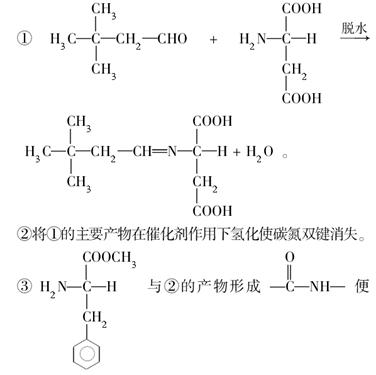
以上三个反应中,②属于________反应(填反应类型),③属于________反应。