下列有关实验操作中,正确的是
| A.pH试纸在使用前先用蒸馏水润湿 | B.用酸式滴定管量取25.00 mL NaOH溶液 |
| C.容量瓶在使用前要检查是否漏水 | D.用50 mL量筒量取18.42 mL稀硫酸 |
在标准状况下,a g气体 A与b g气体B的分子数相同。则与此有关的下列说法中不正确的是()
| A.气体A与气体B的摩尔质量之比为a:b |
| B.同温同压下,气体A与气体B的密度之比为b:a |
| C.质量相同的气体A与气体B的分子数之比为a:b |
| D.相同状况下,同体积的气体A与气体B的质量之比为a:b |
用48mL0.1mol·L—1的FeSO4溶液,恰好还原2.4×10—3mol[RO(OH)2]+,则R元素的最终价态为()
| A.+2 | B.+3 | C.+4 | D.+5 |
对于反应O3+I—+H+——I2+O2+H2O(未配平),下列说法正确的是()
| A.O2和H2O是还原产物 | B.该反应能说明O3氧化性大于I2 |
C.氧化产物与还原物的物质的量之比是1:1 |
D.配平后的化学方程式为:2O3+2I—+4H+I2+2O2+2H2O |
一定能在下列溶液中大量共存的离子组是
| A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
| B.c(H+)=1×10-13 mol·L-1的溶液:Na+、Ca2+、SO42-、CO32- |
| C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- |
| D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
下列反应的离子方程式正确的是()
A.向NaHCO3溶液中加入过量的Ba(OH)2溶液: Ba2++HCO3-+OH-= BaCO3↓+H2O |
B.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-3Fe3++NO↑+2H2O  |
C.氢氧化镁加入醋酸:Mg(OH)2+2H+Mg2++2H2O |
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O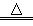 Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |