下列离子方程式正确的是( )
| A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全: Ba2++OH- +H+ + SO4 2-= BaSO4↓+H2O |
| B.用石墨作电极电解氯化镁溶液:2Cl- +2H2O=Cl2↑+H2↑+2OH- |
| C.向Ca(OH)2溶液中滴加同浓度的少量Ca(HCO3)2溶液: Ca2+ + HCO-3 + OH-= CaCO3↓ + H2O |
| D.FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
丁烷有两种常见裂解方式,每种方式均分别生成一种烷烃和一种烯烃。若丁烷裂解率为90%,两种裂解方式生成的烯烃的质量相等,则裂解后所得混合气体中,相对分子质量最小的气体的体积分数约为
| A.19% | B.25% | C.36% | D.40% |
A、B分别为同一主族第三周期、第四周期的不同元素的原子,它们原子核内质子数均等于中子数。若A为ⅡA 族,其质量数为x,则B的质子数为Z;若A为ⅣA族,其质子数为y,则B的质量数为N。Z和N为下列哪一组值
A.Z: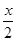 +18,N:2y+18B.Z:
+18,N:2y+18B.Z: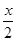 +8, N:2y+18
+8, N:2y+18
C.Z: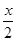 +8, N:2y+36D.Z:
+8, N:2y+36D.Z: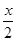 +18, N:2y+36
+18, N:2y+36
下列方法中可以证明2HI(气) H2(气)+I2(气)已达平衡状态的是
H2(气)+I2(气)已达平衡状态的是
① 单位时间内生成n mol H2的同时生成n mol HI
② 一个H-H键断裂的同时有两个H-I键断裂
③温度和压强一定时混合气体密度不再变化
④ 反应速率υ(H2)=υ(I2)=0.5υ(HI)时
⑤ c(HI)=c(H2)=c(I2)=2:1:1
⑥ 温度和体积一定时,某一生成物浓度不再变化
⑦ 温度和体积一定时,容器内压强不再变化
⑧ 条件一定,混合气体的平均相对分子质量不再变化
⑨ 温度和体积一定时混合气体的颜色不再变化
| A.②③④⑤⑥ | B.②⑥⑦⑧⑨ | C.①②⑥⑧ | D.②⑥⑨ |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.Z与Y形成的化合物可作为耐高温材料 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.原子半径按X、Y、Z、R、W的顺序依次增大 |
| D.熔沸点:X2R>X2Y |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+3、+5、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来