下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g) ΔH =-483.6 kJ·mol–1,则氢气的燃烧热为241.8 kJ·mol–1 2H2O(g) ΔH =-483.6 kJ·mol–1,则氢气的燃烧热为241.8 kJ·mol–1 |
B.已知C(石墨,s) C(金刚石,s) ΔH>0,则石墨比金刚石稳定 C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
C.已知OH–(aq)+H+(aq) H2O(l) ΔH=-57.4 kJ·mol–1,则含20.0 g NaOH的稀溶液与CH3COOH的稀溶液完全中和,放出的热量等于28.7 kJ H2O(l) ΔH=-57.4 kJ·mol–1,则含20.0 g NaOH的稀溶液与CH3COOH的稀溶液完全中和,放出的热量等于28.7 kJ |
D.已知2C(s)+2O2(g) 2CO2(g) ΔH1 2C(s)+O2(g) 2CO2(g) ΔH1 2C(s)+O2(g) 2CO(g) ΔH2,则ΔH1>ΔH2 2CO(g) ΔH2,则ΔH1>ΔH2 |
下表中所示物质或概念间的从属关系符合右图的是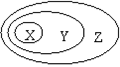
| X |
Y |
Z |
|
| A. |
钠元素 |
主族元素 |
短周期元素 |
| B. |
电解质 |
化合物 |
纯净物 |
| C. |
氢氧化铁 |
胶体 |
分散系 |
| D. |
置换反应 |
氧化还原反应 |
放热反应 |
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:
根据上述实验,以下说法正确的是
| A.溶液甲中一定含有K2SO3、NaNO2 |
| B.无法判断溶液中是否有K2SO3 |
| C.气体A和气体B-定为混合物 |
| D.原混合物中一定有Fe2O3 |
①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是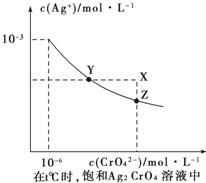
| A.在t℃时,Ag2CrO4的Ksp为1×10-9 |
| B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点 |
| C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107 |
已知酸性: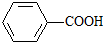 >H2CO3>
>H2CO3>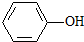
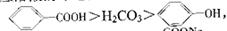 综合考虑反应物的转化率和原料成本等因素,将
综合考虑反应物的转化率和原料成本等因素,将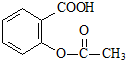 转变为
转变为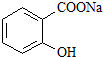 的最佳方法是
的最佳方法是
| A.与稀H2SO4共热后,加入足量NaOH溶液 |
| B.与稀H2SO4共热后,加入足量NaHCO3溶液 |
| C.与足量的NaOH溶液共热后,再加入适量H2SO4 |
| D.与足量的NaOH溶液共热后,再通入足量CO2 |
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是
| A.原H2S溶液的物质的量浓度为0.05 mol/L |
| B.氢硫酸的酸性比亚硫酸的酸性强 |
| C.b点水的电离程度比c点水的电离程度大 |
| D.a点对应溶液的导电性比d点强 |