早在1807年化学家戴维用电解熔融氢氧化钠制得钠: 4NaOH(熔)
4NaOH(熔)  4Na +O2↑+ 2H2O;
4Na +O2↑+ 2H2O;
后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH  Fe3O4+2H2↑十4Na↑。下列有关说法正确的是 ( )
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是 ( )
| A.电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-=H2↑+O2↑ |
| B.若戴维法与吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| C.吕萨克法制钠原理是利用铁的还原性比钠强 |
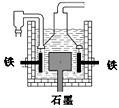
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨为阳极,铁为阴极 |
能正确表示下列反应的离子方程式的是
| A.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O |
| B.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑ |
| C.将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| D.将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
下列能在溶液中大量共存的一组离子是
| A.K+、Na+、NO3-、ClO- | B.Fe3+、H+、I-、HCO3- |
| C.NH4+、Ag+、OH-、Cl- | D.Fe2+、Mg2+、SO42-、MnO4- |
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
| A.干燥Cl2 | B.吸收HCl |
| C.制取Fe(OH)2沉淀 | D.稀释浓H2SO4 |
下列溶液中,不能鉴别SO2和CO2的是
①石灰水②H2S溶液③酸性KMnO4溶液④溴水⑤酸化的Ba(NO3)2溶液⑥品红溶液
| A.①②③⑤ | B.只有① |
| C.②③④⑤ | D.①③ |
下列实验不能验证Na2O2与H2O反应后的溶液中存在大量H2O2的是
A.向溶液中加入 酚酞试剂 酚酞试剂 |
B.向溶液中加入MnO2粉末 |
| C.向溶液中通入CO2气体 | D.向溶液中加入KMnO4溶液 |