下列离子方程式正确的是:
| A.漂白粉溶液中通入少量的SO2:Ca2++SO2+H2O+ClO-=CaSO3↓+2HClO |
| B.过量的小苏打混合:Ca2++ 2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
| C.铜溶于FeCl3溶液中:Fe3++Cu=Fe2++Cu2+ |
| D.稀硝酸加入过量的铁粉:Fe + NO3-+4H+=Fe3++NO↑+2H2O澄清石灰水与 |
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
| A.原子半径由小到大的顺序:X< Y < Z< W |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH > 1 |
化学中常借助图像来表示某种变化过程,下列关于四个图像的说法正确的是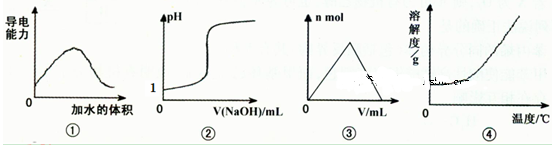
| A.图①可表示t℃时,冰醋酸稀释过程中溶液导电性的变化 |
| B.图②可表示向一定量盐酸中滴加一定浓度氢氧化钠溶液时,溶液pH的变化 |
| C.图③可表示向一定量明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀的物质的量的变化 |
| D.图④可表示所有的固体物质溶解度随温度的变化 |
根据碘与氢气反应的热化学方程式,下列判断正确的是
① I2(g)+ H2(g)  2HI(g) △H=-9.48 kJ/mol
2HI(g) △H=-9.48 kJ/mol
② I2(s)+ H2(g)  2HI(g)△H="+26.48" kJ/mol
2HI(g)△H="+26.48" kJ/mol
| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.当反应②吸收52.96kJ热量时转移2mole一 |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ |
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。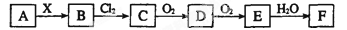
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
向一定量的Cu、Fe2O3的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
| A.3.2 g | B.2.4 g | C.1.6 g | D.0.8 g |