在25ºC时,某氯化铵溶液的pH=4,下列说法中不正确的是:
| A.溶液中c(H+)>c(OH-),且Kw=c(H+).c(OH-)=1×10-14mol2/L2 |
| B.由水电离出来的H+浓度为1×10-4mol/L-1 |
| C.溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.此溶液中由水电离出来的c(H+)=c(OH-) |
盖斯定律在生产和科学研究中有很重要的作用,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知7.2 g碳在12.8g的氧气中燃烧,至反应物耗尽,放出x kJ热量。已知单质碳的燃烧热为y 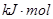
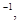 则1 mol C与
则1 mol C与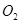 反应生成CO的反应热
反应生成CO的反应热 H为
H为
A.-(2.5x -0.5 y)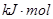 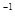 |
B.-(5x - 0.5y) 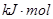 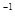 |
C.-(10x - y)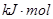 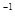 |
D.- y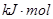 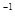 |
在容积一定的密闭容器中发生可逆反应Y(g)+2X(g) 2Z(g);△H>0,平衡移动关系如图所示。下列说法正确的是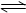
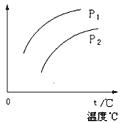
| A.P1>P2,纵坐标指Y的质量分数 |
| B.P1< P2,纵坐标指X的转化率 |
| C.P1> P2,纵坐标指Z的质量分数 |
| D.P1< P2,纵坐标指混合气体的平均摩尔质量 |
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4(g)完全燃烧生成CO2(g)和H2O(l)时,放出445 kJ的热量,则下列热化学方程式中正确的是
| A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)ΔH=" +890" kJ·mol-1 |
| B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=" +890" kJ·mol-1 |
| C.1/2CH4(g)+O2(g)═ 1/2CO2(g)+H2O(l)ΔH=" -890" kJ·mol-1 |
| D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=" -890" kJ·mol-1 |
在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2mol SO3,经过一段时间后,测得容器内的压强为起始时的1.2倍。则SO3的转化率为
| A.25% | B.40% | C.35% | D.80% |
在过量的盐酸中加入等质量的锌在不同的试验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的试验组别可能是

| A.4-3-1-2 | B.1-2-3-4 | C.1-2-4-3 | D.3-4-2-1 |