反应N2+O2=2NO,在密闭容器中进行,能加快该反应速率的是[ ]
| A.扩大体积使压强增大 | B.体积不变充入N2使压强增大 |
| C.体积不变充入He使压强增大 | D.压强不变充入N2使体积增大 |
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下: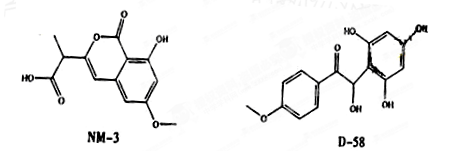
关于NM-3和D-58的叙述,错误的是()
| A.遇FeCl3溶液都显色,原因相同 | B.都不能发生消去反应,原因相同 |
| C.都能与溴水反应,原因不完全相同 | D.都能与NaOH溶液反应,原因不完全相同 |
某有机物A在一定条件下既可以氧化成羧酸,又可以还原成醇,该酸和该醇可生成分子式为C4H8O2的酯B,则下列说法错误的是()
A.有机物A既有氧化性又有还原性
B.有机物A能发生银镜反应
C.在质量一定的情况下,任意混和A、B,混合物完全燃烧所得到二氧化碳的量相等
D.有机物A是乙醛的同系物
除去下列物质中所含少量杂质(括号内为杂质),所选试剂和分离方法能达到实验目的是
| 混合物 |
试剂 |
分离方法 |
|
| A |
乙烷(乙烯) |
H2、催化剂 |
-------- |
| B |
甲苯(苯酚) |
溴水 |
过滤 |
| C |
溴乙烷(溴) |
Na2SO3 |
分液 |
| D |
乙酸乙酯(乙酸) |
NaOH溶液 |
分液 |
下列三种有机物是某些药物中的有效成分: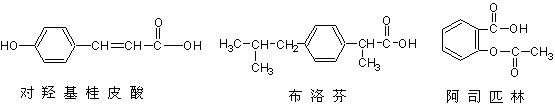
以下说法正确的是()
| A.三种有机物都能与浓溴水发生反应 |
| B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 |
| C.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多 |
| D.使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物 |
ABS合成树脂的结构可表示为
则合成该树脂的单体的种类和化学反应所属类型,正确的是( )
| A.1种,加聚反应 | B.2种,缩聚反应 |
| C.3种,加聚反应 | D.3种,缩聚反应 |