下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是
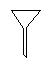


| A.蒸馏、蒸发、萃取、过滤 | B.蒸馏、过滤、萃取、蒸发 |
| C.萃取、过滤、蒸馏、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有()
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为 mol
mol
③反应过程中转移的电子数为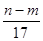 mol
mol
④生成NO气体的体积为 L
L
⑤与合金反应反应的硝酸的物质的量为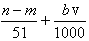 mol
mol
| A.2项 | B.3项 | C.4项 | D.5项 |
早在1807年化学家戴维用电解熔融氢氧化钠制得钠: 4NaOH(熔)
4NaOH(熔)  4Na +O2↑+ 2H2O;
4Na +O2↑+ 2H2O;
后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH  Fe3O4+2H2↑十4Na↑。下列有关说法正确的是 ( )
Fe3O4+2H2↑十4Na↑。下列有关说法正确的是 ( )
| A.电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-=H2↑+O2↑ |
| B.若戴维法与吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 |
| C.吕萨克法制钠原理是利用铁的还原性比钠强 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨为阳极,铁为阴极 |
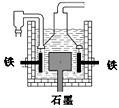
下列实验操作中正确的是()
| A.除去N2中的少量O2:通过灼热的Cu网, 收集气体 |
| B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2 |
| C.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体 |
| D.测溶液的PH值需先用蒸馏水润湿PH试纸,再用干燥洁净的玻璃棒蘸溶液滴在试纸上,与标准比色卡对照 |
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:Pb(s) + PbO2(s) + 2 H2SO4(aq)  2 PbSO4 (s) +2 H2O (l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是()
2 PbSO4 (s) +2 H2O (l)电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是()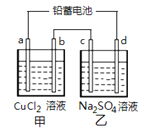
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s) + 4 H+(aq)+SO4 2-(aq)+4e- = PbSO4 (s) +2H2O (l) |
| D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) 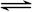 2XY3(g)△H=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g)△H=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热 23.15 kJ |
| ② |
0.6 |
1.8 |
0.8 |
Q(Q>0) |
下列叙述不正确的是()
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ