下列各组物质,前者加入后者时,无论前者是否过量,都能用同一离子方程式表示的是(还原性Fe2+> Br-> C1-) ( )
| A.稀盐酸,碳酸钠溶液 | B.稀盐酸,碳酸氢钠溶液 |
| C.碳酸氢钠溶液,澄清石灰水 | D.氯水,溴化亚铁溶液 |
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g)  C(g) +3D(g)△H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是()
C(g) +3D(g)△H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是()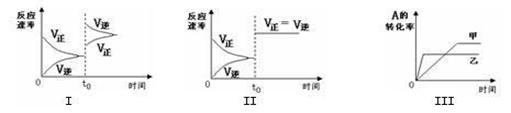
| A.图I可体现t0时升高温度对反应速率的影响 |
| B.图II可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图III可体现温度对化学平衡的影响,且乙的温度较高 |
| D.图III可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法错误的是()
| A.电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 |
| B.H2(g)+F2(g)=2HF(g)△H="-270" kJ/mol ,1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
| C.相同状况下,反应2SO2+O2=2SO3是一个放热反应,则反应2SO3=2SO2+O2是一个吸热反应 |
| D.破坏1 mol氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol氯气中的化学键消耗的能量为Q2 kJ,形成1 mol氯化氢中的化学键释放的能量为Q3 kJ,则Q1+Q2<2Q3 |
如图所示实验,如x轴表示流入阴极的电子的物质的量,则y轴可表示()
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的pH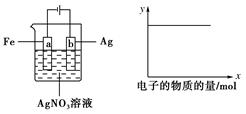
| A.①③ | B.③④ | C.①②④ | D.①②⑤ |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是()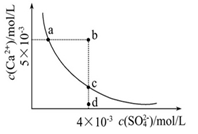
| A.常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/L Na2SO4溶液后,溶液中无沉淀析出 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.d点溶液通过蒸发可以变到c点 |
D.a 点对应的Ksp等于c点对应的Ksp 点对应的Ksp等于c点对应的Ksp |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)  2NH3(g)△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
2NH3(g)△H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是()
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ