将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是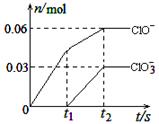
| A.苛性钾溶液中KOH的物质的量是0.09mol |
| B.ClO3-的生成是由于氯气的量的多少引起的 |
| C.在酸性条件下ClO-和ClO3-可生成Cl2 |
| D.反应中转移电子的物质的量是0.21mol |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
溶解度:Na2CO3>NaHCO3 |
向饱和的Na2CO3溶液中通入CO2,析出白色晶体 |
| B |
CaSO3是难溶物 |
向CaCl2溶液中通入SO2产生白色沉淀 |
| C |
NH3能使酚酞溶液变红 |
NH3可用于设计喷泉实验 |
| D |
强酸可与碱及弱酸盐反应 |
用硫酸清洗锅炉中的水垢 |
下列各组物质中,满足表中图示物质在通常条件下能一步转化的组合只有
| 序号 |
X |
Y |
Z |
W |
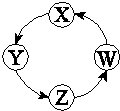 |
| ① |
Cu |
CuSO4 |
Cu(OH)2 |
CuO |
|
| ② |
Na |
NaOH |
Na2CO3 |
NaCl |
|
| ③ |
Cl2 |
Ca(ClO)2 |
HClO |
HCl |
|
| ④ |
Fe |
FeCl3 |
FeCl2 |
Fe(OH)2 |
A.①②③B.①③④C.②③D.①②④
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
| A.溶液A和B均可以是盐酸或NaOH溶液 |
| B.溶液A和B均可以选用稀硝酸 |
| C.若溶液B选用浓硝酸,则测得铜的质量分数偏小 |
| D.实验室方案Ⅱ更便于实施 |
实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏低的原因是
| A.暴露在空气中称量碳酸钠晶体(Na2CO3•10H2O)的时间太长 |
| B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 |
| C.定容时俯视刻度线 |
| D.称量碳酸钠晶体(Na2CO3•10H2O)的烧杯未干燥 |