反应A+3B=2C+D在四种不同情况下的反应速率分别为
①v(A) =0.15mol/(L·s) ②v(B)=0.6mol/(L·s) ③v(C)=0.5mol/(L·s)
④v (D) =0.45mol/(L·s)
则反应进行由快到慢的顺序为( )
A.④>③>①>② B.②>④>③>① C.②>③>④>① D.④>③>②>①
下列物质的转化在给定条件下能实现的是
①
②
③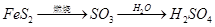
④
⑤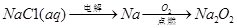
| A.①③ | B.①④ | C.②④ | D.③⑤ |
用下列实验装置进行相应实验,能达到实验目的是
| A.用图1所示装置制取少量的氨气 |
| B.用图2所示装置配制一定物质的量浓度的硫酸 |
| C.用图3所示装置从食盐水中提取NaC1 |
| D.用图4所示装置除去NO2中的NO |
下列有关物质的性质和应用不相对应的是
| A.Na2O2能与CO2反应生成O2,可用于潜艇内供氧 |
| B.C12能与水反应生成HC1O,可用于自来水的消毒 |
| C.Mg在空气中燃烧时发出耀眼的白光,可用于制造信号弹 |
| D.N2与O2在放电时反应生成NO,此反应用于工业上制硝酸 |
反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
| A.该反应是吸热反应 |
| B.催化剂改变了该反应的焓变 |
| C.催化剂降低了该反应的活化能 |
D.该反应的焓变△H=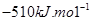 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 、 、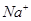 、 、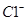 、 、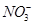 |
B. 的溶液: 的溶液: 、 、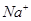 、 、 、 、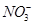 |
C. 的溶液: 的溶液: 、 、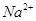 、 、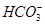 、 、 |
D.与铝反应产生大量氢气的溶液: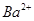 、 、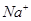 、 、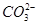 、 、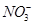 |