下列叙述正确的是
| A.氧化还原反应的本质是化合价发生变化 |
| B.有单质产生的分解反应一定是氧化还原反应 |
| C.氧化剂在同一反应中既可以是反应物,也可以是生成物 |
| D.还原剂在反应中发生还原反应 |
下列解释事实的离子方程式正确的是
A.铁和稀硝酸反应制得浅绿色溶液:Fe+ 4H+ + NO3- Fe3+ + NO↑+ 2H2O Fe3+ + NO↑+ 2H2O |
B.实验室盛碱液的瓶子不用玻璃塞:SiO2 + 2OH-  SiO32-+ H2O SiO32-+ H2O |
C.用稀盐酸和大理石反应制取CO2:CO32- + 2H+  CO2↑ + H2O CO2↑ + H2O |
D.向Ca(ClO)2溶液中通入过量CO2制取次氯酸: 2ClO-+ H2O + CO2 2HClO + CO32- 2HClO + CO32- |
铁氧体(Fe3O4)法是处理含铬废水的常用方法.其原理是:用FeSO4把废水中Cr2O72-还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物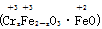 。 处理含1 mol Cr2O72-废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
。 处理含1 mol Cr2O72-废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
| A.x=1,a=5 | B.x=0.5,a=8 |
| C.x=2,a=10 | D.x=0.5,a=10 |
将一定量的SO2通入Ca(ClO)2溶液中,下列反应的离子方程式一定错误的是
| A.SO2+H2O+Ca2++2ClO-====CaSO3↓+2HClO |
| B.SO2+H2O+Ca2++2ClO-====CaSO4↓+HClO+H++Cl- |
C.2SO2+2H2O+Ca2++2ClO-====CaSO4↓+4H++2Cl-+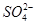 |
| D.SO2+H2O+Ca2++3ClO-====CaSO4↓+2HClO+Cl- |
有关电解质的下列叙述正确的是
| A.甲酸溶液导电性比乙酸溶液导电性强,说明乙是弱酸 |
| B.氧化钾溶于水能导电,所以氧化钾是电解质 |
| C.强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 |
| D.某物质能导电,说明该物质一定含有自由移动的微粒 |
对于2NaBr+Cl2 ="==" NaCl+Br2,下列说法不正确的是
| A.该反应既是置换反应,又是氧化还原反应 |
| B.Cl2是氧化剂,发生还原反应 |
| C.若有1.6g Br2生成,则反应过程中转移了0.02NA个电子 |
| D.钠元素在反应中价态不变,所以NaBr既不是氧化剂,又不是还原剂 |