下列叙述中正确的是
| A.常温下,浓硫酸可以用铁制容器盛放 |
| B.SO2具有漂白性,可以使石蕊溶液褪色 |
| C.硅的化学性质不活泼,在自然界主要以游离态存在 |
| D.氯气具有强还原性,可以用于自来水的杀菌、消毒 |
在甲酸的下列性质中,可以证明它是弱电解质的是
| A.1mol/L的甲酸溶液中c(H+)约为1×10-2 mol/L |
| B.甲酸能与水以任意比例互溶 |
| C.1mol/L的甲酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应 |
| D.甲酸溶液的导电性比盐酸弱 |
微型钮扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,负极反应为:Zn+2OH--—2e-==ZnO+H2O;正极反应为:Ag2O+H2O+2e-==2Ag+2OH-,根据反应式,判断下列叙述正确的是
| A.在使用过程中,电池正极区溶液的pH增大 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Zn是正极,Ag2O是负极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
下列现象不能用盐类水解知识解释的是
| A.明矾能用于净水 |
| B.泡沫灭火器的原理 |
| C.铜绿的生成 |
| D.配置FeCl2溶液时加入少量的盐酸 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是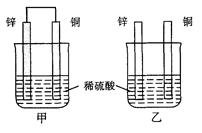
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |