聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性。以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程如下图
下列有关说法中不正确的是( )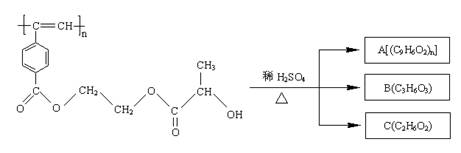
A.M、A均能使酸性高锰酸钾溶液和溴水褪色
B.B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应
C.1molM与热的烧碱溶液反应,可消耗2n mol的NaOH
D.A、B、C各1mol分别与金属钠反应,放出的气体的物质的量之比为1:2:2
合金是一类用途广泛的金属材料。下列物质中,不属于合金的是 ( )
| A.碳素钢 | B.黄铜 | C.硬铝 | D.水银 |
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质是()
| A.无水硫酸铜 | B.硫酸亚铁 | C.食盐 | D.生石灰 |
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应
Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1molAlN需转移3mol电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41g |
下列反应中,硝酸既表现酸性,又表现氧化性的是()
| A.Fe2O3跟稀硝酸反应 | B.Al(OH)3跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 | D.Fe(OH)2跟稀硝酸反应 |
氨气的喷泉实验体现了氨气的什么性质( )
| A.极易溶解于水 | B.密度比空气小 |
| C.与水反应生成碱性物质 | D.氨气易液化 |