硝酸铜是制备Cu—Zn—Al系催化剂的重要原料。现有三种制取硝酸铜的实验方案可供选用
①铜与稀硝酸反应制取:3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
②铜与浓硝酸反应制取:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:
2Cu+O2 2CuO,CuO+2HNO3=Cu(NO3)2+H2O
2CuO,CuO+2HNO3=Cu(NO3)2+H2O
下列说法正确的是 ( )
| A.制取等量的硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,硝酸的利用率为③>①>② |
| D.三种方案的反应都可以在铁质容器中进行 |
下列实验操作能达到实验目的的是
| 编号 |
实验目的 |
实验操作 |
| A. |
测定溶液的pH值 |
用广泛pH试纸测得溶液的pH为2.3 |
| B. |
鉴别苯与二甲苯 |
分别取样,滴加溴水,充分振荡 |
| C. |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D. |
准确测定体积25 mL浓度约为0.15mol·L-1HCl溶液的浓度 |
用25.00 mL碱式滴定管和0.1000mol·L-1 NaOH溶液滴定 |
对于如下反应,其反应过程的能量变化示意图如图:
| 编号 |
反应 |
平衡常数 |
反应热 |
| 反应① |
A(g)=B(g)+C(g) |
K1 |
△H1 |
| 反应② |
B(g)+C(g)=D(g) |
K2 |
△H2 |
| 反应③ |
A(g)= D(g) |
K3 |
△H3 |
下列说法正确的是
A.K3 =K1 + K2 B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快
D.则增大压强,K1减小,K2增大,K3不变
有机物的结构可用键线式表示,如CH2=CHCH2Br可表示为 。下列关于两种有机化合物A和B的说法中错误的是
。下列关于两种有机化合物A和B的说法中错误的是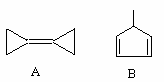
| A.有机物A分子所有碳原子均在同一平面上 |
| B.有机物B的化学式为C6H8 |
| C.有机物A的二氯取代产物有4种 |
| D.等物质的量的A和B与H2完全加成消耗H2的量相同 |
下列说法正确的是
| A.ΔH>0,ΔS>0的反应任何条件都是非自发反应; |
B.因N2(g)+3H2(g)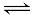 2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ 2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
C.一定温度下,在固定体积密闭容器中,发生反应:2SO2(g)+O2(g)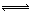 2SO3(g) △H<0,当v正(SO2)= v正(SO3)时,说明该反应已达到平衡状态 2SO3(g) △H<0,当v正(SO2)= v正(SO3)时,说明该反应已达到平衡状态 |
| D.H2标准燃烧热△H="-285.8" kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)==2H2O(g) △H=-571.6 kJ·mol-1 |
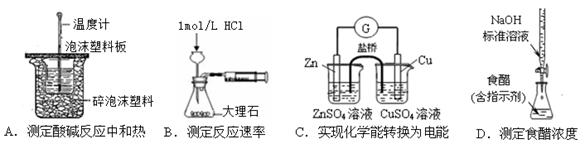
下列实验装置选择正确,能达到目的的是