下列现象或反应的原理解释正确的是
| 选项 |
现象或反应 |
原理解释 |
| A |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝导热性强,温度达不到着火点 |
| B |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| c |
向某溶液中加入盐酸酸化的氯化钡溶液, 有白色沉淀生成 |
该溶液中不一定含有S04一 |
| D |
铜与浓硝酸反应生成N02,而与稀硝酸 反应生成NO |
浓硝酸的氧化性弱于稀硝酸的氧化性 |
有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。则A的相对分子质量是
A.29 |
B.29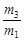 |
C.29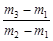 |
D.29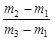 |
已知某饱和溶液的:①溶液的质量;②溶剂的质量;③溶液的体积;④溶质的摩尔质量;⑤溶质的溶解度;⑥溶液的密度。以上条件的组合中不能用来计算该饱和溶液的物质的量浓度的是
| A.①③④ | B.④⑤⑥ | C.①②③④ | D.①③④⑤ |
有下列仪器:①漏斗;②锥形瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;⑦燃烧匙。其中常用于分离物质的仪器是
| A.①③④ | B.①②⑥ | C.①③⑤ | D.③④⑦ |
有下列仪器:①烧杯;②蒸发皿;③平底烧瓶;④试管;⑤坩埚;⑥锥形瓶。其中可以用酒精灯直接加热的仪器是
| A.①②④⑤⑥ | B.②④⑤ | C.①③⑥ | D.④⑥ |
用下列方法来制备胶体,能够得到胶体的是
| A.将等体积、等物质的量浓度的BaCl2溶液和硫酸相混合并振荡 |
| B.把1 mL饱和三氯化铁溶液逐滴加入到20 mL温水中,边加边振荡,并加热到沸腾 |
| C.把1 mL饱和三氯化铁溶液一次性加入到20 mL沸水中,并加以搅拌 |
| D.把1 mL饱和三氯化铁溶液逐滴加入到20 mL沸水中,边加边振荡 |