(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子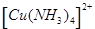 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
(1)写出步骤①、②、④分离提纯的方法:
①②④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、溶液、溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应。向所得溶液中滴加至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论。
(5)写出加入试剂a后,发生反应的离子方程式、
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式。
(1)写出硫酸铁在水溶液中电离的电离方程式
(2)用双线桥法,标出下列氧化还原反应的电子转移方向和电子总数
2FeCl3+Fe=3FeCl2氧化剂是(填化学式)
(3)氨的催化氧化是工业上制硝酸的基础:4NH3 + 5 O2 4NO + 6H2O ,其中作为还原剂的物质是(填化学式);若反应中生成了0.2 mol NO,则转移mol电子,
4NO + 6H2O ,其中作为还原剂的物质是(填化学式);若反应中生成了0.2 mol NO,则转移mol电子,
(4)在一定条件下,RO3n-和氯气可发生如下反应: RO3n- + Cl2 + 2OH- = RO42- + 2Cl- +H2O由以上反应可知在上过程中RO3n-被(填“氧化”或“还原”), RO3n-中元素R的化合价是。
有下列物质:①二氧化碳 ②硝酸钾晶体 ③液氯 ④氢气 ⑤氯水 ⑥石墨 ⑦氢氧化钠固体 ⑧稀硫酸 ⑨熔融氯化钠 ⑩铝。请用序号回答下列问题:
(1)属于混合物的是;属于非金属单质的是。
(2)属于电解质的是;能够导电的是。
(3)能与稀盐酸发生氧化还原反应的是;该反应的离子方程式为:
(1)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
①若溶液中只溶解了一种溶质,该溶质的名称是,上述离子浓度大小顺序关系中正确的是(选填序号)。
②若上述关系中C是正确的,则溶液中溶质的化学式是。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)c(Cl-)。
(2)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)。
A.9 B.9~11之间 C.11~13之间 D.13
(3)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)。
A.氨水与氯化铵发生化学反应;
B.氯化铵溶液水解显酸性,增加了c(H+);
C.氯化铵溶液水解显碱性,降低了c(H+);
D. 氯化铵溶于水,电离出大量铵根离子,抑制了氨水的电离,使c(OH-)减小;
工业上通常在恒容密闭容器中采用CO(g)和H2 (g)反应催化合成甲醇CH3OH(g):
(1)已知:① 2CO(g) + O2 (g) = 2CO2 (g)ΔH =" -566.0" kJ·mol-1
② 2H2(g) + O2 (g) ="2" H2O (g)ΔH =" -398.0" kJ·mol-1
③2CH3OH(g) +3O2 (g) =2CO2 (g) +4 H2O(g)ΔH =" -1104.0" kJ·mol-1
则CO(g)与H2(g)合成CH3OH(g)的热化学方程式是_______________。
(2)据研究,反应过程中起催化作用的为CuO,反应体系中含少量CO2有利于维持催化剂CuO的量不变,原因是:_______________________________ (用化学方程式表示)。
(3)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A. 混合气体的密度不变
B. 混合气体的平均相对分子质量不变
C. CH3OH(g)、CO(g)、H2(g)的浓度都不再发生变化
D.生成CH3OH(g)的速率与消耗CO(g)的速率相等
(4)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.250 |
0.012 |
某温度下,将2molCO(g)和6mol H2(g)充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol/L,则CO(g)的转化率为________,此时的温度为__________。
(5)要提高CO(g)的转化率,可以采取的措施是__________。
A. 升高温度 B. 加入催化剂 C. 增加CO(g)的浓度
D. 加入H2(g)加压 E. 分离出甲醇 F.加入惰性气体加压
(6)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 反应物投入量 |
1molCO 2molH2 |
1molCH3OH |
2molCH3OH |
|
| 平衡数据 |
CH3OH的浓度(mol/L) |
c 1 |
c 2 |
c 3 |
| 反应的能量变化的绝对值(kJ) |
a |
b |
c |
|
| 体系压强(Pa) |
P1 |
P2 |
P3 |
|
| 反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是__________。
A. 2c1>c3 B. a+b=129 C. 2p2<p3 D. α1+α3<1