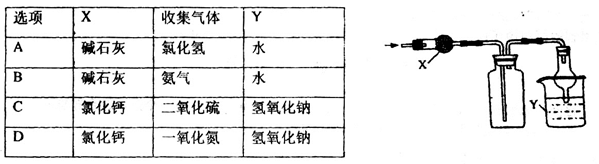
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法错误的是
| A.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ |
| B.根据反应①和②推知反应: H2(g)+1/2O2(g)=H2O(g)的△H=-241.9kJ/mol |
| C.CH3OH转变成H2的过程不一定要吸收能量 |
| D.反应①中的能量变化如图所示 |
固体粉末X中可能含有Fe、FeO、CuO、MnO2、KCl和K2CO3中的若干种。为确定该固体粉末的成分,某同学依次进行了以下实验:
①将X加入足量水中,得到不溶物Y和溶液Z
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物
③向Z溶液中滴加AgNO3溶液,生成白色沉淀
④用玻璃棒蘸取溶液Z于广泛pH试纸上,试纸呈蓝色
分析以上实验现象,下列结论正确的是
| A.X中一定不存在FeO |
| B.不溶物Y中一定含有Fe和CuO |
| C.Z溶液中一定含有KCl、K2CO3 |
| D.Y中不一定存在MnO2 |
往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图像部分重叠)溶液中离子的对应关系,正确的是
| A.a:Cl-b:K+ c:CO32- d:HCO3- |
| B.a:K+ b:CO32- c:Cl- d:HCO3- |
| C.a:K+ b:CO32- c:HCO3- d:Cl- |
| D.a:K+ b:HCO3- c:Cl- d:CO32- |
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是
| A.白色沉淀不含BaSO3 | B.溶液的酸性减弱 |
| C.白色沉淀是BaSO4 | D.FeCl3全部被还原为FeCl2 |
将2aL Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,其中一份加入b mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c mol NH3,则原混合溶液中的Al3+离子浓度(mol/L)为( )
A.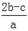 |
B.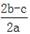 |
C.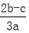 |
D. |
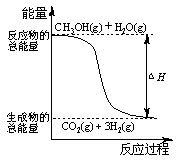
右图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是()