在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)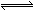 CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
| A.800℃下,该反应的化学平衡常数为0.25 |
| B.427℃时该反应的平衡常数为9.4,则该反应的△H<0 |
| C.800℃下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% |
| D.800℃下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7% |
有一充有10mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有6mL无色气体,则原混合气体中NO和NO2体积比为
| A.1∶4 | B.2∶3 |
C.1∶3 | D.4∶1 |
在一定体积的18mol/L的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,则浓H2SO4的实际体积
| A.等于50mL | B.大于50mL | C. 等于100mL 等于100mL |
D.大于100ml |
下列哪种试剂一次性实验就能鉴别四种溶液:Na2CO3、(NH4)2SO4、NH4Cl、KNO3
| A.AgNO3溶液 | B.NaOH溶液 | C.Ba(OH)2溶液 | D.盐酸 |
根据原子序数判断 下列各组元素中能形成AB2型化合物的是
下列各组元素中能形成AB2型化合物的是
| A.6和10 | B.12和8 | C.10和13 | D.12和9 |
某元素原子L层电子数比M层电子数多5个,该元素的最高正化合价为
| A.+3 | B.+4 | C.+5 | D.+6 |