使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)配制100 mL待测白醋溶液。量取10.00 mL市售白醋,注入烧杯中用水稀释后转移到 (填仪器名称)中定容,摇匀即得。
(2)用 量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2_____作指示剂。
(3)读取盛装0.100 0 mol·L-1 NaOH溶液的 (填仪器名称)的初始读数。如果液面位置下图所示,则此时的读数为 mL。
(4)滴定。滴定过程中,眼睛应观察 。滴定终点后记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
| 滴定次数 实验数据/mL |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=[(15.95+15.00+15.05+14.95)/4] mL=15.24mL。
指出他的计算的不合理之处:______________________________________。
按正确数据处理,可得c(市售白醋)=___________mol·L-1;市售白醋总酸量=_________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_______ (填写序号)。
a.未用标准NaOH溶液润洗滴定管
b.锥形瓶中加入待测白醋溶液后,再加少量水
c.锥形瓶在滴定时剧烈摇动,有少量液体溅出
d.滴定前锥形瓶用待测白醋溶液润洗
下图是实验室制取Cl2并以纯净、干燥的Cl2为原料进行特定反应的实验装置图: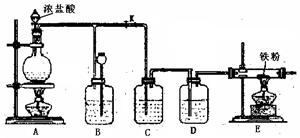
(1)写出实验室制取氯气的离子反应方程式:。
(2)C中盛装的液体是,D中盛装的液体是。
(3)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃E处的酒精灯。E装置内盛有铁粉,写出E装置中反应的化学方程式:。 (4)E处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是,B的作用是。
(4)E处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是,B的作用是。
(5)该装置的设计是否合理(填“是“或 “否”),如果不合理,请加以改正。
某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
请回答下列问题:
(1)写出II中反应的化学方程式 。
(2)观察到II中的现象是 。
(3)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是 。
(4)能说明苯与液溴发生了取代反应的现象是 。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;④加入无水CaCl2粉末干燥;
⑤ (填操作名称)。
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。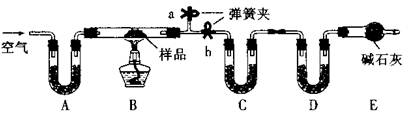
(1)实验时,B中发生反应的化学方程式为,。
(2)装置C、D中盛放的试剂分别为:
C,D(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是,它在该实验中的主要作用是;
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将(填“偏高”、“偏低”或“无影响”)
(5)反应前,在B装置中通入空气可减少实验误差,操作方法是。
实验题(12分)。已知在常用催化剂(如铂、钯)的催化下,氢气和炔烃加成生成烷烃,难于得到烯烃,但使用活性较低的林德拉催化剂[Pd/(PdO、CaCO3),其中钯附着于碳酸钙及少量氧化铅上],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.020molCaC2的电石和1.60g含杂质18.7%的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL。试回答有关问题。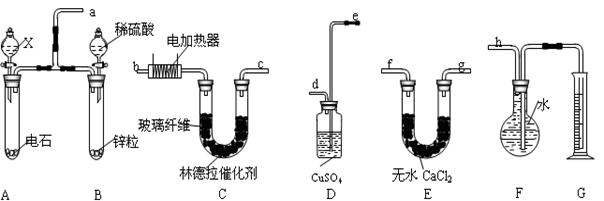 (1)所用装置的连接顺序是a、、、、、、、h(填各接口的字母)。
(1)所用装置的连接顺序是a、、、、、、、h(填各接口的字母)。
(2)写出A中所发生反应的化学方程式(有机物写结构简式):。
(3)D的作用是___________________。
(4)为减慢A中的反应速率,X应选用____________________________。
(5)F中留下的气体除含少许空气外,还有_______________________________。G所选用的量筒的容积较合理的是______________。
A.500mLB.1000mLC.2000mL
(6)若V=672mL(导管内气体体积忽略不计),则乙炔氢化的转化率为_______________。
实验目的:探究(一)同周期元素性质的递变规律
探究(二)影响化学反应速率的因素
供选试剂:锌片、锌粉、铁片、铁粉、镁条、铝条、新制Na2S溶液、新制氯水、
0.5mol/L盐酸、3mol/L盐酸等试剂(实验仪器自选)。
现有A同学设计的部分实验方案,请你帮他填写完整,并作出评价。
【实验探究一】同周期元素金属性和非金属性的递变规律
| 实验步骤 (画图表示,参照下图) |
实验现象 |
实验结论 |
|
| 非金属性递变 |
|||
| 金属性递变 |
【实验探究二】影响化学反应速率的因素
实验步骤 |
实验现象 |
实验结论 |
 (锌片和锌粉的质量相同,盐酸均过量) |
均有气体生成,锌粉比锌片消失快。 |
反应物接触面积越大,反应速率越快 |
A同学在[实验探究二]中所得结论不够严谨。原因是___________________________。
在不改变实验探究二所做实验的前提下,再补充一些实验即可完成有关探究,补充实验是(写最简方案,可不填满,也可增加):
①_________________________________;
②_________________________________;
③_________________________________。