下列与化学反应能量变化相关的叙述正确的是
A.生成 物能量一定低于反应物总能量 物能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH不同 |
关于工业转化图(见下图),下列说法不正确的是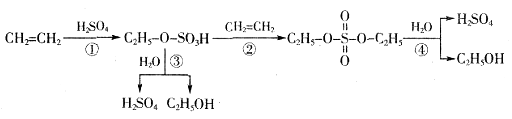
| A.该过程是一种“对环境友好型”工业生产硫酸的方法 |
| B.从以上物质的转化过程可看出硫酸可作乙烯水化法制乙醇的催化剂 |
| C.该过程中①②是加成反应 |
| D.该过程中③④是酯类的水解 |
下列除杂,所用试剂和操作均正确的是
| 选项 |
物质成分(括号内为杂质) |
所用试剂 |
操作 |
| A |
铁屑(油污) |
纯碱溶液 |
洗涤 |
| B |
苯(苯酚) |
溴水 |
过滤 |
| C |
碳酸钡(硫酸钡) |
盐酸 |
溶解、过滤 |
| D |
乙醇(乙酸) |
烧碱溶液 |
分液 |
有关物质的转化关系如下图所示(部分物质和条件已省去),C、X均是单质,H溶液呈浅绿色,I溶液呈棕黄色。下列有关判断正确的是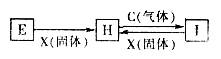
A. X固体可能是碘单质
B. 图中所示反应均为氧化还原反应
C. 1mol C与E溶液完全反应转移电子数为NA(NA为阿伏加德罗常数)
D. E、H、I溶液配制时,均需加酸防止其水解
化学与科学、技术、社会和环境密切相关。下列有关说法中错误的是
| A.太阳能电池板中的硅,在元素周期表中处于金属与非金属的交界位置 |
| B.加热能杀死H7N9型禽流感病毒,是因为病毒的蛋白质受热变性 |
| C.煤的气化或液化技术,可以降低污染 |
| D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 |
物质的量之比为2︰5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
| A.1︰4 | B.1︰5 | C.2︰3 | D.2︰5 |