在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )。
| A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1 |
| B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1 |
| C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1 |
| D.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8x-2y) kJ·mol-1 |
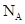 表示阿伏加德罗常数,下列说法不正确的是
表示阿伏加德罗常数,下列说法不正确的是
A.1molNH4+和1molOH-所含电子数均为10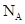 |
B.14gC2H4和14gC3H6所含原子数均为3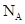 |
| C.1L l mol/LH2SO4溶液与Zn反应生成22.4L |
D.标准状况下,11.2LSO3所含分子数为0.5 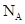 |
下列说法正确的是
| A.SO2能使溴水、KMnO4水溶液褪色 |
| B.可以用澄清石灰水鉴别SO2与CO2 |
| C.硫粉在过量的纯氧中燃烧可以生成SO3 |
| D.少量SO2通入浓的CaCl2溶液能生成白色沉淀 |
等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元
素的质量相等,则AlCl3和NaOH两种溶液物质的量浓度之比是
①l: 3 ②2: 3 ③1: 4 ④2: 7
| A.①和② | B.①和③ | C.②和④ | D.③和④ |
在实验室里可按如图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
| A.HCl | B.Cl2 |
| C.CO | D.NH3 |
常温下将盛有10 mL NO2和10 mL NO的混合气体的试管倒立于水槽中,并向其中通入O2一段时间后,试管内还剩余2 mL气体,则通入O2的体积为
| A.8mL | B.8.5mL | C.l0mL | D.12mL |