Ⅰ.如何降低大气中CO2的含量及有效利用CO2,目前已引起各国普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) 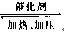 CH3OH(g)+H2O(g) 。
CH3OH(g)+H2O(g) 。
实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。 
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________________;
②图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是
热(填“吸”或“放”)反应。
③该反应的平衡常数K为 (保留两位小数)。若提高温度到800℃进行,达平衡时,K值 (填“增大”、“减小”或“不变”),
④500℃达平衡时,CH3OH的体积分数ω为 。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为_________ ____ ___。
Ⅱ.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3),其三步反应如下:
1. 2H2 (g)+CO(g)  CH3OH (g) ΔH=-90.8 kJ·mol-1
CH3OH (g) ΔH=-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH=-41.3 kJ·mol-1
(3)总合成反应的热化学方程式为__________ _ 。
(4)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
| A.高温高压 |
| B.加入催化剂 |
| C.减少CO2的浓度 |
| D.增加CO的浓度 |
E.分离出二甲醚
(5)已知反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”)。
根据以下反应,写出各物质的化学式及①②③的方程式。
(1)A是________,B是________,C是________,D是________。
(2)化学反应方程式:①________________;
②________________;
③________________。
水是组成生命体的重要化学物质,有关水的反应实例有很多:
(1)有人设想将太阳能转化为电能,进而将水电解生成H2,H2是一种清洁能源。请分析电解水过程中,水(填“仅被氧化”“仅被还原”“既被氧化,又被还原”或“既未被氧化,又未被还原”,下同)。
(2)野营爱好者携带氢化钙固体作为生氢剂,反应方程式为:CaH2+2H2O Ca(OH)2+2H2↑,其中水。
Ca(OH)2+2H2↑,其中水。
硫酸氢钠(NaHSO4)在水溶液中可以完全电离为Na+和HSO ,HSO
,HSO 在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO
在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO 。不过,在浓度大的溶液中HSO
。不过,在浓度大的溶液中HSO 不能完全电离,而是与H+、SO
不能完全电离,而是与H+、SO 共同存在于同一溶液中。
共同存在于同一溶液中。
(1)硫酸氢钠(NaHSO4)所属的物质类别是()
| A.酸 | B.盐 | C.碱 | D.氧化物 |
(2)NaHSO4溶液的pH7。(填“>”“<”或“=”=
(3)在稀NaHSO4溶液中加入Na2CO3溶液时,可以得到无色、无味的气体,该气体可以使澄清石灰水变浑浊。写出稀NaHSO4溶液与Na2CO3溶液反应的化学方程式和离子方程式。
(已知锌与铝具有一定的相似性,如都能在强碱性溶液中形成酸根阴离子。实验室分析白铁(镀锌的铁)样品成分,称取1.00 g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到有大量气体冒出,后来放出气体速率变慢,至不再放出气体。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加强热至质量不变,最后得到1.20 g红色粉末。
(1)白铁镀锌的作用是______________;盖玻璃片的作用是____________。
(2)放出气体速率由快变慢的原因是_______________________________________。
(3)为什么要加入过量NaOH溶液__________________________________________。
(4)样品中锌的质量分数是_______________________________________________。
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业上冶炼金属的还原剂。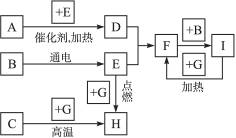
请按要求填空:
(1)写出下列物质的化学式:A______________,B____________,C____________。
(2)写出A→D的化学方程式________________________。
(3)写出G和I的浓溶液反应的化学方程式:________________________。