下列叙述正确的是 ( )
| A.纯碱、烧碱均属碱 | B.SiO2、SO2均属酸性氧化物 |
| C.凡能电离出H+的化合物均属酸 | D.盐类物质一定含有金属离子 |
从某微粒的原子结构示意图反映出
| A.质子数和中子数 |
| B.中子数和电子数 |
| C.核电荷数和核外电子层排布的电子数 |
| D.质量数和核外电子层排布的电子数 |
不同元素的原子(包括离子)
| A.质子数一定不等 | B.中子数一定不等 |
| C.质量数一定不等 | D.核外电子数一定不等 |
提出元素周期律并绘制了第一个元素周期表的科学家是
| A.戴维 | B.阿伏加德罗 | C.门捷列夫 | D.道尔顿 |
对于可逆反应:2AB3(g) 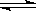 A2(g) + 3B2(g)△H>0,下列图像正确的是
A2(g) + 3B2(g)△H>0,下列图像正确的是
(其中AB3%是平衡时质量分数)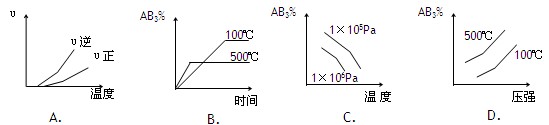
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |