三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3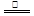 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是( )
| A.C3N3(OH)3与HNCO为同一物质 |
| B.HNCO是一种很强的氧化剂 |
| C.1 mol NO2在反应中转移的电子为24 mol |
| D.反应中N2既是氧化产物又是还原产物 |
已知常温下反应①NH3+H+ NH
NH (平衡常数为K1),②Ag++Cl-
(平衡常数为K1),②Ag++Cl- AgCl(平衡常数为K2),③Ag++2NH3
AgCl(平衡常数为K2),③Ag++2NH3 Ag(NH3)
Ag(NH3) (平衡常数为K3)。
(平衡常数为K3)。
①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是
| A.氯化银不溶于氨水 |
| B.银氨溶液中加入少量氯化钠有白色沉淀 |
| C.银氨溶液中加入盐酸有白色沉淀 |
| D.银氨溶液可在酸性条件下稳定存在 |
关于下列各装置图的叙述中,不正确的是
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
下列各环境下的离子组合一定能大量共存的是
| A.c(HCO3-)=1×10-1mol/L的溶液中Na+、Al3+、CH3COO-、K+ |
| B.由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+ |
| C.甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+ |
| D.能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42- |
已知:Ksp(CuCl,白色)=1.2×10-6,Ksp(CuOH,橙黄色)=1.2×10-14。如图,用铜电极电解饱和食盐水时,阳极发生的电极反应为Cu-e-+Cl-==CuCl。下列说法不正确的是
| A.B极发生的电极反应为2H++2e-==H2↑ |
| B.实验开始时,A极附近出现白色浑浊 |
| C.电解时,Na+移向A极 |
| D.一段时间后,U形管底部形成橙黄色沉淀 |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |