苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知: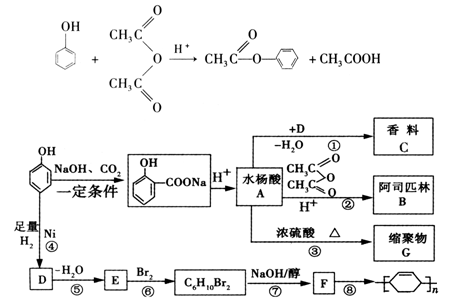
(1)写出C的结构简式 。
(2)写出反应②的化学方程式 。
(3)写出G的结构简式 。
(4)写出反应⑧的化学方程式 。
(5)写出反应类型:④ ,⑦ 。
现有下列七种物质,根据要求填空:
A液氧 B KCl C冰水混合物 D氖 E干冰 F Na2CO3 G食盐水
(1)直接由原子构成的物质是(填编号,下同);
(2)只由分子构成的物质是;
(3)只由离子构成的物质是。
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,_______段收集的氢气最多。
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 ,一定时间后反应速率逐渐减慢,其原因是
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是()
| A.蒸馏水 |
| B.氯化钠固体 |
| C.氯化钠溶液 |
| D.浓盐酸 |
E.降低温度
一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如Fe+Cu2+===Fe2++Cu,可拆写为氧化反应式:Fe-2e-===Fe2+,还原反应式:Cu2++2e-===Cu2+。据此,回答问题:
将反应Zn+2H+===Zn2++H2↑拆写为两个 “半反应式”:
氧化反应式:____________________,还原反应式:__________________。
根据同一氧化还原反应对比氧化性、还原性强弱的原理,请设计一个实验证明铁离
子的氧化性强于铜离子
。
高锰酸钾和浓盐酸可以发生下列反应:
2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)该反应的氧化剂是______,还原剂是________。
(2)若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是________ mol。