草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO4- + H 2C2O4 + H+ ——Mn2++ CO2↑+ H2O(未配平)
用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H 2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| I |
2 mL |
20 |
|
| II |
2 mL |
20 |
10滴饱和MnSO4溶液 |
| III |
2 mL |
30 |
|
| IV |
1 mL |
20 |
1 mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,使用实验 和 (用I~IV表示,下同);如果研究温度对化学反应速率的影响,使用实验 和 。
(2)对比实验I和IV,可以研究 对化学反应速率的影响,实验IV中加入1 mL蒸馏水的目的是 。
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD
结构简式为: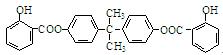
BAD的合成路线如下: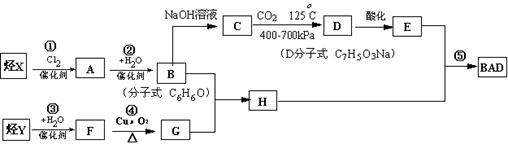
试回答:
(1) 写出结构简式Y ________________________ D____________________。
(2) 属于取代反应的有_____________________________(填数字序号)。
(3) 1molBAD最多可与含____molNaOH的溶液完全反应
(4) 写出反应④方程式____ ____________________________________________
____________________________________________
⑸写出B+G→H方程式________________________________________________。
(6) E的同分异构体有下列性质:①与FeCl3反应,溶液呈紫色;;②能发生银镜反应,则该同分异构体共有种
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 。氧元素与氟元素能形成OF2分子,该分子的空间构型为 。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是 ;1 mol O22+中含有的π键数目为 。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。
Cr3+基态核外电子排布式为 。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构如图所示,则该钙的氧化物的化学式为 。
(5)下列物质的分子与O3分子的结构最相似的是。
A. H2O B . CO2C. SO2 D. BeCl2
. CO2C. SO2 D. BeCl2
(6)O3分子是否为极性分子
(15分)
工业上以磷肥生产形成的副产物石膏(CaSO4·2H2O)与焦炭为原料可生产硫酸,同时可以得到硫酸钾肥料和氯化钙水合物储热材料。以下是有关的工艺流程示意图。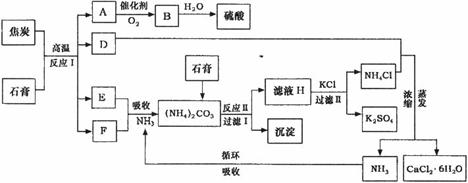
试回答:
(1)写出方程式:反应Ⅰ___________________________________,
(2)写出方程式:反应Ⅱ______________________________________。
(3)请根据下表和化学平衡知识,分析工业上制硫酸中SO2的催化氧化的适宜条件是
____________________________________。
表Ⅰ:
 压强 / M Pa 压强 / M Pa转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
(4)检验滤液H中含有CO 的方法是___________________________________。
的方法是___________________________________。
(5)氯化钙结晶水合物(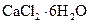 )是目前常用的无机储热材料,选择的依据是___________
)是目前常用的无机储热材料,选择的依据是___________ (填序号)。
(填序号)。
a.熔点较低(29℃熔化) b.能导电 c.易溶于水 d.无毒
物质A、B、C、D为中学常见单质,其组成元素的原子序数依次减小,且其中只有三种是短周期元素,B为黄绿色气体。试根据下图中物质的相互转化关系回答下列问题。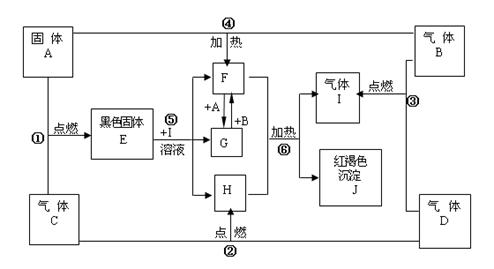
(1)A是_________
(2)在 的转化中,A的作用是;在①~⑥的反应中,不属于氧化
的转化中,A的作用是;在①~⑥的反应中,不属于氧化 还原反应的是。(多填或少填无分)
还原反应的是。(多填或少填无分)
(3)写出A在高温下与H反应的化学反应方程式并标出电子转移的方向和数目
。
(4)写出反应⑥的化学反应方程式 。
(5)已知在101 kPa 条件下,2 mol D完全燃烧生成液态生成物放出571.6 kJ热量;请书写表示D燃烧热的热化学方程式:
(14分)D、E为中学化学常见的金属单质,在一定条件下C、D间能发生反应.各物质转化关系如下图: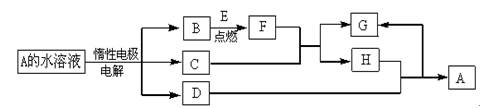
⑴B的同素异形体的名称为:_____________;H的化学式为:_____________.
⑵写出D与H反应的离子方程式_____________.
⑶用惰性电极电解A 溶液的阳极反应式为:_____________.
⑷检验H和G的混合溶液中含有G的阳离子的试剂可以是:_____________.
a.氯水和KSCN溶液 b.氢氧化钠溶液 c.酸性KMnO4溶液
⑸用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8 g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH.则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________.