下列关于反应热的表述正确的是 ( )
A.当△H<0时,表示该反应为吸热反应
B.需要加热才能进行的反应是吸热反应
c.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1mO1NaOH分别和1mo1CH COOH、1mO1HNO
COOH、1mO1HNO 反应放出的热量:CH
反应放出的热量:CH COOH<HNO
COOH<HNO
有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,使之能够实现循环利用,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此构想的物质循环图中太阳能最后转化为()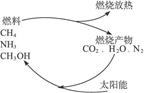
| A.化学能 | B.热能 | C.生物能 | D.电能 |
聚丙烯酸酯类涂料是目前市场上流行的墙面涂料之一,它具有弹性好、不易老化、耐擦洗、色泽亮丽等优点。如下是聚丙烯酸酯的类别,它属于()
①无机化合物 ②有机化合物 ③高分子化合物 ④离子化合物 ⑤共价化合物
| A.①③④ | B.①③⑤ | C.②③⑤ | D.②③④ |
下列说法中正确的是()
| A.凡能发生银镜反应的有机物一定是醛 |
| B.在氧气中燃烧时只生成CO2和H2O的物质一定是烃 |
| C.乙酸是有机弱酸,所以它的酸性比碳酸弱 |
| D.在酯化反应中,羧酸脱去羧基中的羟基,醇脱去羟基中的氢原子而生成酯 |
下列物质为2005年新合成的一种有机物:
形成该有机物使用的单体有()
| A.2种 | B.3种 | C.4种 | D.5种 |
下列反应属于可逆反应的是()
| A.Cl2溶于水的反应 |
| B.氢气和氧气的反应 |
| C.电解水生成H2和O2,点燃H2和O2的混合物生成H2O |
| D.实验室加热二氧化锰和浓盐酸的混合物制取氯气的反应 |