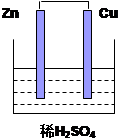某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1mol·L-1FeCl3溶液、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+ 、Fe3+的氧化性、还原性,并对实验结果加于应用。
(1)兴趣小组通过对Fe2+、Fe3+ 的价态分析,对Fe2+、Fe3+ 的氧化性、还原性提出了如下3种假设:
假设一:Fe2+具有 性;
假设二:Fe2+具有 性;
假设三:Fe3+具有 性;
(2)设计实验方案,进行实验并描述实验现象,完成下列表格。
| 探究内容 |
实验方案 |
实验现象 |
写出下列离子方程式 |
| 探究Fe2+具有还原性 |
取少量0.1mol·L-1FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量 |
溶液先不变红, 后变为血红色 |
①Fe2+发生的反应: |
| 探究Fe3+具有氧化性 |
取少量0.1mol·L-1FeCl3溶液,加入足量 后,再往溶液中加入少量KSCN溶液 |
溶液不变为血红色 |
②Fe3+发生的反应: |
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2 + Zn ="=" ZnCl2 + Fe
该反应的离子方程式为: 。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是: 。
下表标出的是元素周期表的一部分元素,回答下列问题: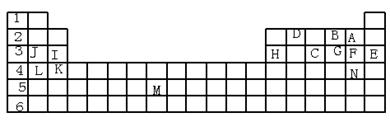
(1)表中用字母标出的14种元素中,化学性质最不活泼的是(用元素符号表示,下同),主族元素中金属性最强的是,非金属性最强是,常温下单质为液态的非金属元素是;属于过渡元素的是(该空用字母表示)。
(2)B、F、C气态氢化物的化学式分别为,
其中以最不稳定。
(3)第三周期中原子半径最小的是。
写出下列物质的电子式和结构式
(1)O2电子式:,结构式:
(2)H2S电子式:,结构式:
写出下列物质的电子式
(3)NaCl电子式:
(4)MgCl2电子式:
请填写下列空白
(1)原子由原子核和构成,原子核由和构成,
带(填质子中子或电子,下同)电(填正或负,下同),带电。
(2)在原子中,原子序数===。
(3)化学键可以分为键和键,键又可以分为极性和非极性。
(4)化学反应究竟要吸收能量还是要放出能量,主要取决于。化学反应的能量变化通常表现为热量的变化。若反应物总能量(填大于、小于或等于,下同)生成物总能量,为放热反应,若反应物总能量生成物总能量,为吸热反应。
(5)烷烃的概念:烃分子中碳原子之间都以碳碳结合成,剩余价键均与原子结合,使每个碳原子的化合价都达到“”,这样的烃又叫做“”。
下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 一 |
(1) |
(2) |
||||||
| 二 |
(3) |
(4) |
(5) |
(6) |
(7) |
|||
| 三 |
(8) |
(9) |
(10) |
(1)请写出(1)--(10)号元素的元素符号
(2)表中能形成两性氢氧化物的元素符号是__________
如图所示的原电池中,回答下列问题
(1)负极材料
(2)写出电极反应式:正极:;负极:。
(3)写出电极反应总反应式
(4)电子由极流向极(填写Zn或Cu)