短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是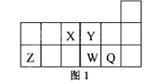
| A.元素X与元素Z的最高正化合价之和的数值等于7 |
| B.原子半径的大小顺序为:rZ>rW>rQ >rY> rX |
| C.离子Y2-和Z 3+的核外电子数、电子层数和质子数都相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
下列与有关机物结构、性质相关的叙述错误的是
| A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
| B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C.甲烷与氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 |
| D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
短周期元素W、X、Y和Z的原子序数依次增大,元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
| A.元素W、X的氯化物中,各微粒均满足8电子的稳定结构 |
| B.元素X与氢形成的电子比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,对下列实验现象或实验操作解释正确的是
| 现象或操作 |
解释及结论 |
|
| A |
将胆矾放入坩埚中加热脱水,晶体由蓝色变为白色 |
胆矾晶体易失结晶水 |
| B |
苯酚中滴加溴水有白色沉淀 |
苯酚与溴发生了加成反应 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
| D |
蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
此位置指示的是被蒸馏物质的沸点 |
As2S3和HNO3有如下反应:As2S3+10HNO32H3AsO4+3S+10NO2+2H2O,下列说法正确的是
| A.该反应的氧化产物仅为S |
| B.生成1molH3AsO2时。转移电子个数为10NA |
| C.将反应设计成一原电池,则NO2应该在正极附近逸出 |
| D.反应产生的NO2与56LO2混合在水中正好完全反应生成硝酸 |
迷迭香酸是从蜂花属植物中提取得到的酸性物质其结构如图所示:下列叙述正确的是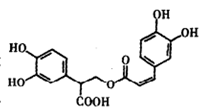
| A.迷迭香酸属于芳香族化合物,分子式C14H18O8 |
| B.迷迭香酸含有和官能团有:羧基、酯基、酯基 |
| C.1mol迷迭香酸最多能和含6mol Br2的浓溴水发生反应 |
| D.1mol迷迭香酸最多与含5mol NaOH的水溶液或9mol H2完全反应 |